近年来,有机化合物作为缓蚀剂已广泛应用于金属的防腐中。常见的有机缓蚀剂是由极性基团 (含电负性较大的O、N、S和P等原子) 和非极性基团 (以C、H原子为中心的烷基R) 组成。极性基团含有杂原子,它能够提供孤对电子给Fe的d空轨道,形成配位键吸附在金属表面,改变金属表面的双电层结构,提高金属离子化过程的活化能。非极性基团在金属表面形成了一层疏水的薄膜,替代了金属表面的腐蚀介质和水分子,将腐蚀介质与金属表面分开,阻碍了腐蚀反应相关的电荷/物质的转移过程,降低了金属的腐蚀速度[6-15]。但大量研究表明,高温会导致缓蚀剂的使用效率显著降低。Chafiq等[16]研究了BITD和BITH两种缓蚀剂在30和60 ℃下的缓蚀效果,结果表明两种缓蚀剂的吸附能随着温度的升高而降低。Verma等[17]研究了3种1-丁基-3-甲基咪唑离子液体缓蚀剂在35、45、55和65 ℃下的缓蚀效果,表明随着温度的升高,3种缓蚀剂的缓蚀率均大幅度下降,这归因于高温下缓蚀剂分子具有高动能,使得缓蚀剂分子易于从金属表面脱附,最终导致缓蚀剂的缓蚀效率下降。因此,发展在宽温域仍能保持缓蚀效率稳定的新型缓蚀剂是非常有意义的。
目前,缓蚀剂的种类有很多,包括链状有机胺及其衍生物、咪唑啉类、季铵盐类、席夫碱及曼尼希碱等。其中,席夫碱缓蚀剂的合成过程简单、毒性低、原料便宜、抗温性能好,能够有效抑制金属的腐蚀[18,19]。Nabatipour等[20]研究了铬基席夫碱缓蚀剂在20、40和60 ℃下的缓蚀性能,结果表明随着温度的升高,2种铬基席夫碱缓蚀剂的缓蚀率逐渐下降,且席夫碱缓蚀剂通过抑制阴极析氢反应而表现出阴极缓蚀剂的性质。Soliman等[21]研究了新型席夫碱缓蚀剂在40和60 ℃下的缓蚀性能,表明随着温度的升高,席夫碱缓蚀剂的缓蚀效率逐渐增加,且席夫碱缓蚀剂的吸附均服从朗缪尔吸附等温线,是具有明显阳极效应的混合型缓蚀剂。Chauhan等[22]研究了三唑席夫碱缓蚀剂在30、35、40和45 ℃下的缓蚀性能,表明随着温度的升高,缓蚀剂的缓蚀效果逐渐下降,这归因于缓蚀剂在金属表面上的解吸。本文合成了新的席夫碱缓蚀剂 (BB-S缓蚀剂和B-S缓蚀剂),测试了缓蚀效率随温度的变化,并研究了温度对席夫碱缓蚀剂吸附的影响机理。
1 实验方法
1.1 实验材料与缓蚀剂合成
实验中所用钢材为N80钢 (油井管用钢,经920 ℃保温30 min后水淬,再在670 ℃经60 min高温回火),成分 (质量分数,%) 为:C 0.34、Si 0.25、Mn 1.60、S 0.015、P 0.020、V 0.11、Cr 0.15、Al 0.020。所用化学试剂包括:盐酸、无水乙醇、苯胺、苯乙酮和二苯甲酮,皆为分析纯。
本文中所使用的两种带有苯基基团的席夫碱缓蚀剂为二苯基席夫碱缓蚀剂 (B-S缓蚀剂) 和三苯基席夫碱缓蚀剂 (BB-S缓蚀剂) 。席夫碱缓蚀剂由含羰基的醛、酮类化合物与一级胺类化合物进行亲核加成反应,亲核试剂为胺类化合物,其化合物结构中带有孤对电子对N原子与羰基基团上带有正电荷的碳原子结合,完成亲核加成反应,形成中间物σ-羰基胺类化合物,然后进一步脱水形成席夫碱化合物,如图1所示。
图1
1.2 腐蚀速率与缓蚀效率评价
采用腐蚀失重的方法对钢材的腐蚀速率进行评价。失重法实验步骤为:(1) 每组实验均选用3个N80钢挂片试样作为平行试样。所用挂片试样尺寸为 50 mm×10 mm×3 mm;(2) 将试样表面用砂纸打磨至 400#,然后在酒精中清洗并擦拭干净。最后用 BS110型电子天平进行称重;(3) 使用IC-202型烘箱调至所需温度,然后将准备好的N80挂片以悬挂的方式放置在分别添有200 mg/L B-S和BB-S缓蚀剂的0.5%盐酸溶液中恒温72 h;(4) 腐蚀实验结束后将试样从反应瓶中取出,用蒸馏水冲洗表面附着的腐蚀介质,用酒精清洗后烘干。用提前配制好的的酸洗液 (成分配比为:HCl体积分数10%,六亚甲基四胺质量分数3%) 将试样表面的腐蚀产物去除后称量。
试样的均匀腐蚀速率rcorr按下式计算:
式中,rcorr为均匀腐蚀速率,mm/a;m0和mt为实验前后试样质量,g;S为试样暴露总面积,cm2;ρ为N80钢材的密度,g/cm3;t为实验时间,h。
采用腐蚀失重的方法对缓蚀剂的缓蚀效果进行评价,缓蚀率按照下式进行计算:
其中,
1.3 电化学测试及红外线测试
利用CHI660D电化学工作站进行电化学测试。采用三电极体系,N80材料为工作电极 (1 cm2),辅助电极为铂电极,参比电极 (SCE) 为饱和甘汞电极。测试溶液为0.5% (质量分数) HCl溶液,测试温度分别为30、50、70和90 ℃,实验周期为3 d。缓蚀剂浓度为200 mg/L。极化曲线扫描速度为0.5 mv/s,电化学阻抗的频率范围为105~10-2 Hz,幅值为10 mV。利用KYKY-EM6200扫描电镜 (SEM) 对腐蚀后的试片进行微观形貌观察。
采用了60SXB红外光谱进行缓蚀剂分子的表征。红外光谱仪由探测器、发射光源、光阑、干涉仪和计算机信息处理系统等部件组合而成。仪器的扫描范围是4000~400 cm-1,分辨率为0.35 cm-1。
1.4 缓蚀剂分子吸附的模拟计算
本文中所有模拟计算均使用Material Studio软件进行。其中,量子化学计算采用Dmol3模块,缓蚀剂分子与金属表面相互作用计算采用DFTB+模块。首先,利用密度泛函理论计算了缓蚀剂分子的前线轨道分布;然后建立席夫碱分子附着在Fe-H2O表面的界面模型,通过分子动力学 (molecular dynamic,MD) 模拟计算吸附在Fe-H2O表面的席夫碱分子的平衡结构;最后用DFTB+方法计算了席夫碱分子在铁表面的吸附能。
席夫碱分子前线轨道分布和前线轨道能级计算由DMol3模块完成,采用B3LYP杂化密度泛函法计算。收敛准则为:能量梯度为0.0002 Ha/nm,最大原子位移为0.0005 nm,相应的总能量收敛到1×10-5 Ha,SCF收敛准则为10-6。其中,量子化学参数的计算如下所示:
分子轨道的能量与电离势 (I) 和电子亲和能 (A) 存在如下关系:
电负性 (χ)、硬度 (η) 和柔软度 (σ) 计算如下:
在Fe(110) 表面建立水环境中席夫碱分子吸附的界面模型。第一步,切割Fe(110) 面,然后扩展到2.674 nm×2.674 nm×0.1433 nm。第二步,构建溶液层,使用含有100个水分子和1个席夫碱分子 (室温下水密度0.9970 g/cm3) 的非晶细胞工具构建。第三步,使用构建层工具构建Fe(110)/water界面。为了避免边界条件的影响,在盒子上放置了1 nm的真空层。第四步,固定所有Fe原子,将密度泛函法优化的席夫碱分子加入体系中优化到最低能量。第五步,用DFTB+计算席夫碱分子在Fe(110) 表面的吸附能,采用了广义梯度 (GGA) 中的Perdew-Burke-Ernzerhof (PBE) 交换相关函数。其中,采用Andersen方法控制温度分别为303,323,343和363 K。模拟步长为1 fs,时间总长为200 ps。最终得到了Fe(110)/水界面的平衡结构以及吸附能。
其中,Etotal表示Fe(001) 表面与吸附缓蚀剂分子的总能量,EFe代表Fe(001) 表面的能量,Einhibitor是缓蚀剂分子能量。
2 结果与讨论
2.1 温度对席夫碱缓蚀剂在盐酸介质中缓蚀作用的影响
2.1.1 红外测试结果
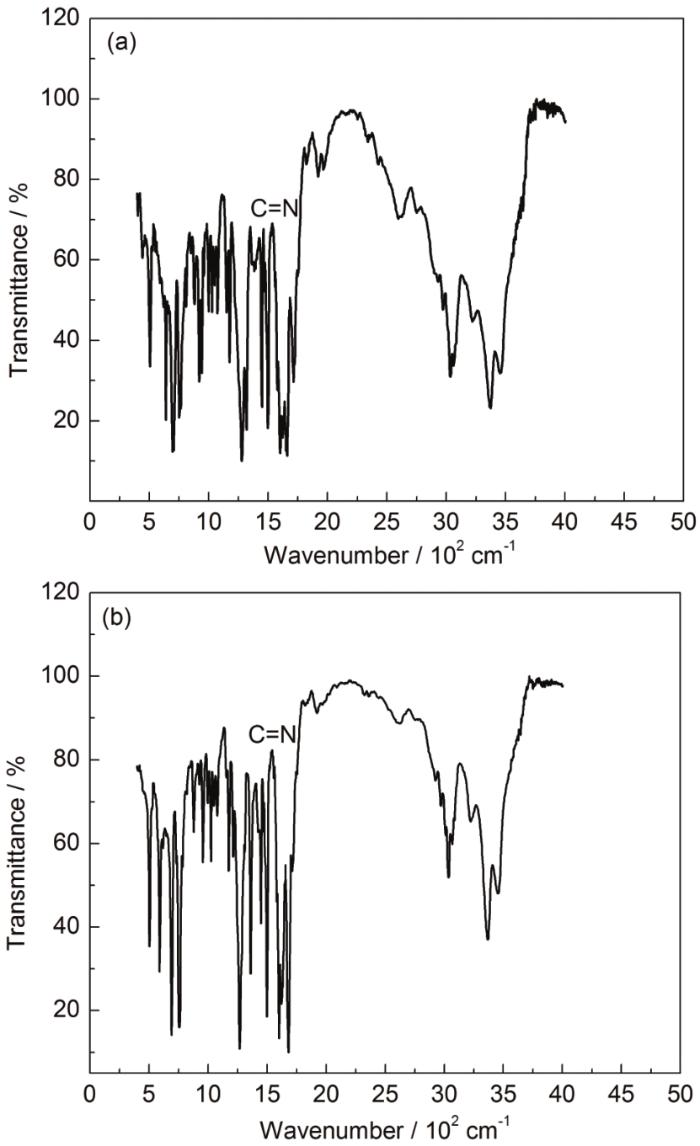
图2是B-S缓蚀剂和BB-S缓蚀剂的红外光谱图。其中 1590~1650 cm-1处为C=N吸收峰,750~760 cm-1和690~700 cm-1为苯环上5个邻接H的吸收峰,2850~2950 cm-1为C-H键吸收峰,确定为B-S缓蚀剂和BB-S缓蚀剂的目标产物。
图2
2.1.2 缓蚀率测试结果
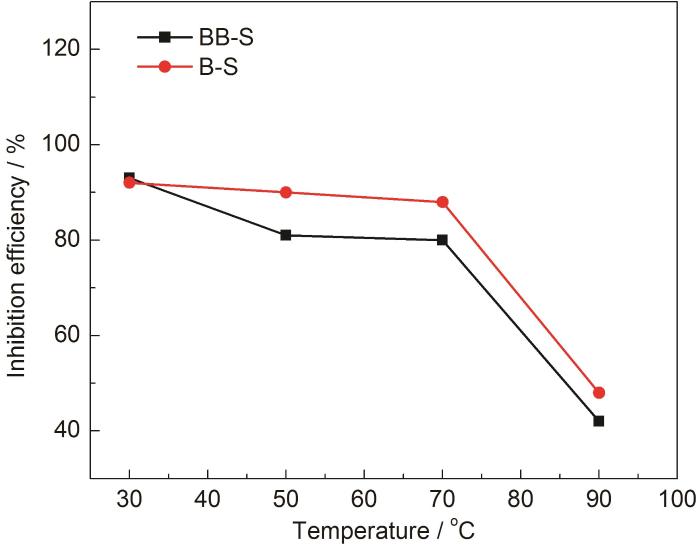
在不同温度下两种缓蚀剂的缓蚀率测试结果如图3所示。对于BB-S缓蚀剂和B-S缓蚀剂,在30、50和70 ℃时它们的缓蚀率较高;当温度为90 ℃时,两种缓蚀剂的缓蚀率显著降低,最低可达42%。因此,BB-S缓蚀剂和B-S缓蚀剂不能够有效抑制90 ℃下的金属腐蚀;只有在70 ℃以下,两种缓蚀剂的缓蚀率可达到80%以上;在50~90 ℃范围,B-S缓蚀剂的缓蚀率要大于BB-S缓蚀剂的。
图3
图3
N80钢在不同温度下添加BB-S和B-S缓蚀剂的缓蚀效率
Fig.3
Inhibition efficiencies of BB-S and B-S inhibitors in 0.5 mol·L-1 HCl solution at different temperatures
2.1.3 腐蚀形貌分析
图4为腐蚀后试样的SEM形貌图。在添加两种缓蚀剂的0.5%HCl溶液中浸泡时,随着温度的升高,试样表面逐渐出现了点蚀坑;在90 ℃时,腐蚀后的试样表面腐蚀最严重。
图4
图4
N80钢在不同温度下添加BB-S和B-S缓蚀剂的腐蚀形貌
Fig.4
Corrosion morphologies of N80 steel after corrosion in 0.5 mol·L-1 HCl solutions containing BB-S (a1~a4) and B-S (b1~b4) inhibitors at 30 ℃ (a1, b1), 50 ℃ (a2, b2), 70 ℃ (a3, b3) and 90 ℃ (a4, b4)
2.1.4 电化学测试结果
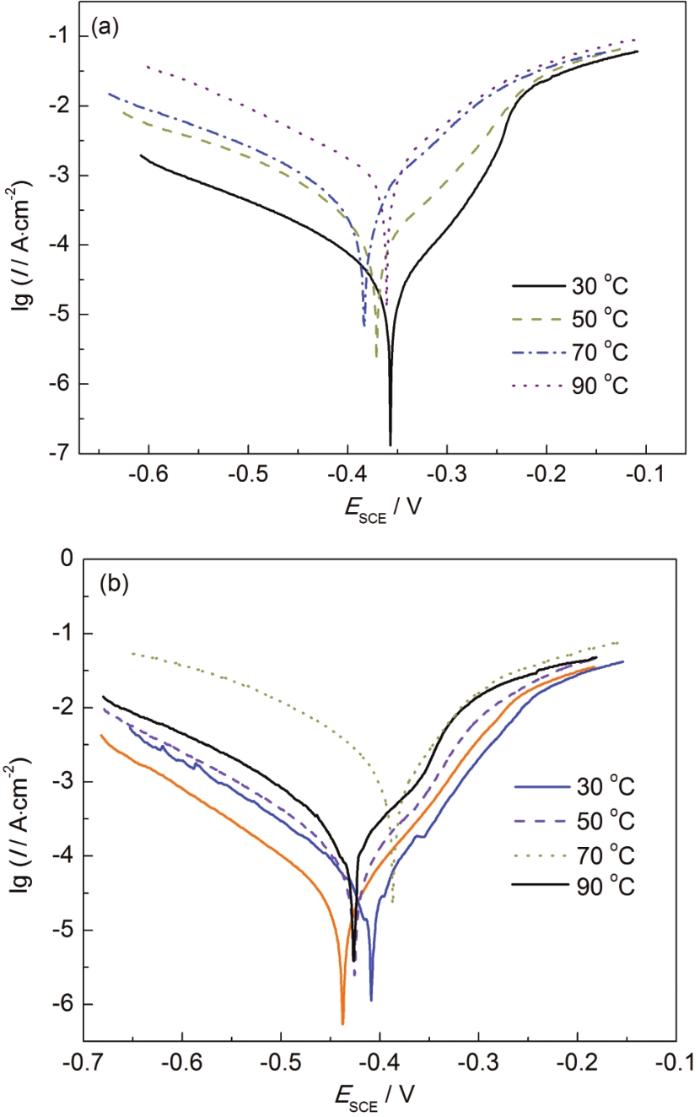
在不同温度条件下,N80电极在分别含有两种席夫碱缓蚀剂的0.5%HCl溶液中获得的动电位极化曲线如图5所示。在含BB-S缓蚀剂的溶液中,温度为30、50和70 ℃时,极化曲线均向负电位方向移动;而在90 ℃时,极化曲线向正电位方向移动。在含B-S缓蚀剂的溶液中,在4种温度下极化曲线均向负方向移动。
图5
图5
N80钢在不同温度下添加BB-S和B-S缓蚀剂的极化曲线
Fig.5
Polarization curves of N80 steel in 0.5 mol·L-1 HCl solutions containing B-S (a) and BB-S (b) inhibitors at different temperatures
从表1中的拟合结果可看出,当温度逐渐升高时,腐蚀电流密度升高,即当温度升高时,缓蚀剂不能有效抑制N80钢的腐蚀。且碳钢的自腐蚀电位随温度的变化均在85 mV以内。B-S缓蚀剂和BB-S缓蚀剂均为混合型缓蚀剂,且B-S缓蚀剂的缓蚀效果要比BB-S缓蚀剂的缓蚀效果好。
表1 在0.5 mol·L-1 HCl溶液中含B-S和BB-S缓蚀剂的N80碳钢不同温度下的电化学极化参数
Table 1
| Corrosion inhibitor | T / ℃ | ba / mV | bc / mV | I / A·cm-2 |
|---|---|---|---|---|
| B-S inhibitor | 30 | 64.0923 | 73.6556 | 0.2356 |
| 50 | 45.5601 | 62.5323 | 0.1358 | |
| 70 | 62.7934 | 69.6143 | 0.0863 | |
| 90 | 57.7803 | 73.6706 | 0.0405 | |
| BB-S inhibitor | 30 | 63.8012 | 78.3209 | 0.5244 |
| 50 | 75.6923 | 70.7412 | 0.4657 | |
| 70 | 71.2741 | 71.1614 | 0.3158 | |
| 90 | 64.5204 | 77.3036 | 0.1335 |
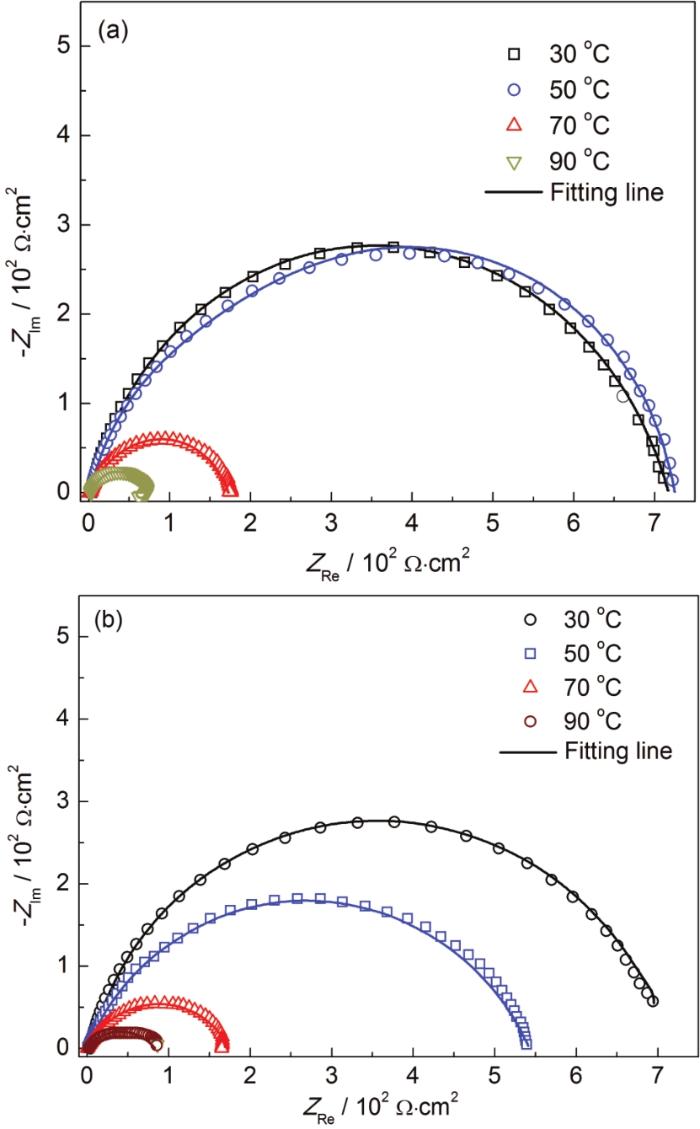
图6
图6
N80钢在不同温度下添加BB-S和B-S缓蚀剂的电化学阻抗谱
Fig.6
EIS plots of N80 steel in 0.5 mol·L-1 HCl solutions containing in B-S (a) and BB-S (b) inhibitors at different temperatures
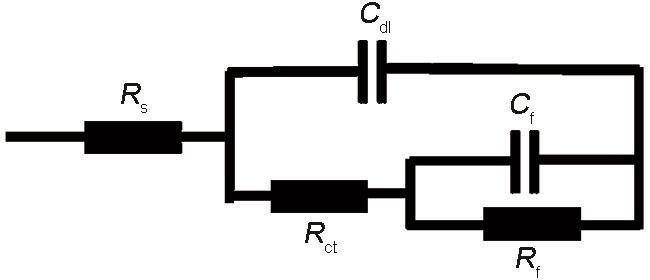
图7
图7
N80钢在添加B-S和BB-S缓蚀剂的溶液中阻抗谱的等效电路图
Fig.7
Equivalent circuit diagram of EIS of N80 steel in HCl solutions containing B-S and BB-S inhibitors
根据下式,由电荷转移电阻 (Rct) 计算缓蚀剂在0.5 mol/L HCl溶液中的缓蚀率μ。
其中,Rct和Rct0分别代表含有和不含有缓蚀剂的电荷转移电阻。
相应的拟合电化学阻抗谱图参数列于表5中。可以看出,随着温度的升高,Cdl的值变大。这种情况可以用Helmholtz方程来分析。
通过Helmholtz方程和表2,可知随着温度的升高,BB-S和B-S缓蚀剂的缓蚀率降低,表明缓蚀剂从金属的表面开始解离,所以缓蚀剂并没有完全取代水分子吸附在钢基体表面,反而由于缓蚀剂的解吸使更多的水分子吸附在钢基体的表面,Cdl的值随着温度的升高而升高。同时,Rct的值随着温度的增加而减小,说明了缓蚀剂不能有效阻碍高温溶液中腐蚀性粒子吸附在金属表面,缓蚀剂在高温时已经失去了保护金属免遭腐蚀的能力。综上所述,缓蚀剂的缓蚀效率由小到大的顺序为BB-S<B-S。所得结论与极化曲线实验结果一致。
表2 在0.5 mol·L-1 HCl溶液中不同温度下的N80钢添加缓蚀剂的阻抗谱参数
Table 2
| Corrosion inhibitor | T / ℃ | RsΩ·cm2 | Cdl10-5 F·cm-2 | RctΩ·cm2 | Cf10-5 F·cm-2 | RfΩ·cm2 |
|---|---|---|---|---|---|---|
| B-S inhibitor | 30 | 2.051 | 8.026 | 749.041 | 4.539 | 21.540 |
| 50 | 1.679 | 8.071 | 732.002 | 6.614 | 22.951 | |
| 70 | 1.534 | 8.908 | 171.387 | 5.132 | 17.040 | |
| 90 | 1.773 | 11.98 | 85.056 | 5.122 | 12.640 | |
| BB-S inhibitor | 30 | 2.696 | 9.542 | 705.345 | 5.350 | 14.160 |
| 50 | 2.298 | 9.798 | 545.567 | 4.327 | 18.130 | |
| 70 | 2.576 | 10.926 | 168.345 | 5.027 | 22.950 | |
| 90 | 2.245 | 16.750 | 93.032 | 4.980 | 10.930 |
2.1.5 量子化学计算结果
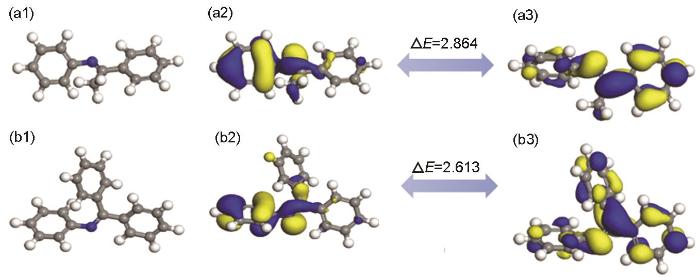
图8分别为B-S和BB-S缓蚀剂分子优化的几何构型以及LUMO和HOMO分布图。如图所示,B-S和BB-S缓蚀剂的HOMO主要分布在靠近C=N双键的苯环以及C=N上,而B-S缓蚀剂的LUMO主要分布在远离C=N双键的苯环上。BB-S缓蚀剂的LUMO主要分布在远离C=N双键的两个苯环上,表明添加苯环只会增加接受来自金属电子的活性位点,不能使缓蚀剂向金属表面提供更多的电子。量子化学计算的相关数据如表3所示。两种席夫碱缓蚀剂的ΔE值由大到小的顺序:BB-S>B-S。说明B-S缓蚀剂分子的活性更强,会稳定的吸附在金属的表面。硬度和软度用来表征分子的稳定性和反应性。硬分子有大的能隙,软分子有小的能隙。软分子比硬分子更活跃,因为它们能轻易地把电子提供给受体。由表3可知,两种席夫碱缓蚀剂的η (硬度) 顺序是BB-S>B-S,σ (软度) 的顺序为BB-S<B-S,即B-S缓蚀剂具有高σ值和低η值,表明B-S缓蚀剂更容易将电子给受体。
图8
图8
前沿轨道能级图
Fig.8
Frontier orbital energy level diagrams of B-S (a) and BB-S (b) inhibitors: (a1, b1) optimized molecular structure of corrosion inhibitor, (a2, b2) HOMO distribution of corrosion inhibitor, (a3, b3) LUMO distribution of corrosion inhibitor
表3 B-S和BB-S缓蚀剂的量子化学参数
Table 3
| Corrosion inhibitor | BB-S | B-S |
|---|---|---|
| HOMO | -5.223 | -4.974 |
| LUMO | -2.310 | -2.110 |
| ΔE | 2.913 | 2.864 |
| I | 5.223 | 4.974 |
| A | 2.310 | 2.110 |
| η | 1.4565 | 1.432 |
| σ | 0.6866 | 0.698 |
| χ | 3.7665 | 3.542 |
2.1.6 分子动力学模拟结果
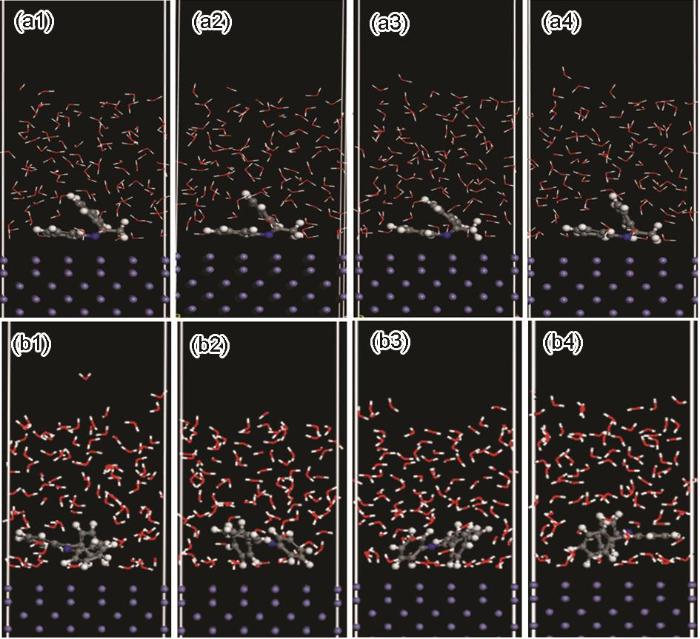
采用DFTB+模拟优化的缓蚀剂吸附构型,进一步研究了两种席夫碱缓蚀剂分子于不同的温度下在Fe(001) 表面的吸附。图9a分别显示了B-S和BB-S缓蚀剂分子吸附在Fe(001) 表面上的优化平衡构型图。从图9中可以观察到,在30 ℃时,B-S缓蚀剂中靠近C=N双键的苯环以及C=N双键以平行的吸附方式吸附在金属的表面,而远离C=N双键的苯环以一定的角度吸附在金属的表面;随着温度的升高,远离C=N双键的苯环角度逐渐变大。如图9b所示,BB-S缓蚀剂的C=N双键以及其中的两个苯环平行地吸附在金属的表面,另一个苯环倾斜的吸附在金属的表面;随着温度的升高,一个以平行吸附的苯环开始以一定角度吸附在铁基体表面;当温度为90 ℃时,两个苯环垂直吸附在金属的表面。模拟计算数据表明,随着温度的升高,两种席夫碱缓蚀剂的吸附构型由平行吸附逐渐向倾斜吸附的方式转变,随之变化的是缓蚀剂缓蚀效率的降低,说明温度的变化影响了缓蚀剂在铁基体表面的吸附构型。与倾斜吸附的方式相比,平行吸附的方式有助于缓蚀剂在金属表面的吸附。
图9
图9
B-S和BB-S缓蚀剂在Fe(110) 表面吸附的最稳定构型
Fig.9
Most stable low energy configurations for the adsorp-tion of B-S (a) and BB-S (b) at 30 ℃ (a1, b1), 50 ℃ (a2, b2), 70 ℃ (a2, b3) and 90 ℃ (a4, b4) corrosion inhibitor on Fe(110) surface
两种缓蚀剂的Ebinding如表4所示。对于BB-S和B-S缓蚀剂,随着温度的升高,缓蚀剂的吸附能逐渐增大,表明这两种缓蚀剂在金属表面上的吸附越来越弱。显然,B-S缓蚀剂的结合能值要小于BB-S缓蚀剂的结合能,证实了B-S缓蚀剂对Fe基底具有最强的吸附能力,BB-S缓蚀剂的缓蚀效果最差。
表4 B-S和BB-S缓蚀剂在不同温度下的吸附能
Table 4
| T / ℃ | BB-S | B-S |
|---|---|---|
| 30 | -1955.26 | -2012.32 |
| 50 | -1885.73 | -1943.07 |
| 70 | -1848.86 | -1942.23 |
| 90 | -1846.54 | -1930.78 |
2.2 温度影响席夫碱缓蚀剂吸附的作用机理
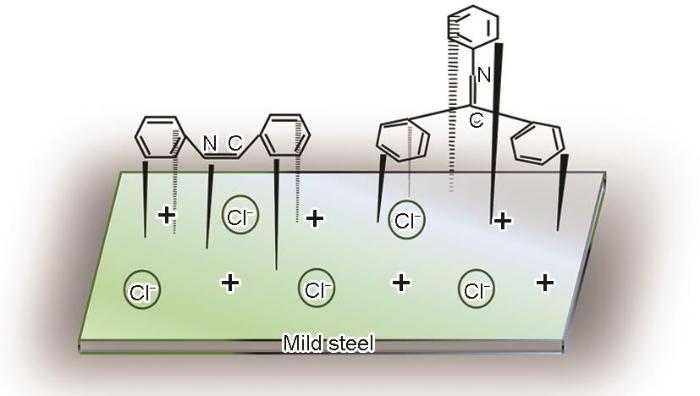
B-S和BB-S缓蚀剂是一种吸附型缓蚀剂,B-S缓蚀剂由两个苯环结构和C=N双键组成,BB-S缓蚀剂具有三个苯环结构和一个C=N双键。缓蚀作用主要是席夫碱缓蚀剂在金属表面形成吸附膜来阻隔腐蚀介质与金属表面的接触,从而起到抑制金属腐蚀的作用。如图10所示,溶液中的阴离子 (如Cl-) 首先吸附在带正电荷的钢材表面。由于C=N双键和苯环中存在孤对电子,这两个席夫碱缓蚀剂容易质子化并带正电荷。然后,带正电荷的缓蚀剂分子通过静电作用 (物理吸附) 吸附到阴离子吸附的钢表面,然后席夫碱缓蚀剂进一步吸附在钢表面形成化学键。席夫碱缓蚀剂中的苯环和C=N双键上存在孤对电子,很容易填充Fe原子外未占据的3d轨道,从而在杂原子与钢基体之间形成配位键,吸附在低碳钢试样表面[31,32]。
图10
图10
B-S和BB-S缓蚀剂的缓蚀机理图
Fig.10
Corrosion inhibition mechanism diagram of B-S and BB-S inhibitors
从失重测试结果可知,B-S和BB-S缓蚀剂随着温度的升高,缓蚀效率逐渐下降,说明温度对席夫碱缓蚀剂的缓蚀效率有抑制作用。当温度为30,50和70 ℃时,在含缓蚀剂溶液中腐蚀后的试样表面比较光滑,具有轻微的腐蚀;温度为90 ℃时,试样表面腐蚀严重,表明席夫碱缓蚀剂在90 ℃时不能有效抑制金属的腐蚀,可能是由于温度的升高,缓蚀剂分子热运动加剧,造成缓蚀剂从金属表面脱离。
从阻抗谱结果可见,在含BB-S和B-S缓蚀剂的溶液中,随着温度的升高,Cdl值逐渐变大,而Rct值逐渐变小,说明缓蚀剂分子并没有完全取代水分子吸附在金属表面。相反,缓蚀剂分子随着温度的升高从金属表面逐渐解吸,破坏了缓蚀剂在金属表面形成的吸附膜。
根据前线轨道理论,BB-S缓蚀剂比B-S缓蚀剂多一个苯环结构,正是由于苯环的影响,B-S缓蚀剂比BB-S缓蚀剂具有更低的硬度和更高的软度,以及更小的能隙,以至于B-S缓蚀剂在30,50,70和90 ℃下的缓蚀效率均大于BB-S缓蚀剂的缓蚀效率。说明添加的苯环结构通过改变缓蚀剂的前线轨道能级抑制了缓蚀剂在不同温度下与金属之间的吸附。同时,由于苯环较大的体积,有可能会造成BB-S缓蚀剂较大的空间位阻抑制其在金属表面的吸附。进一步探究可知,添加的苯环只会增加接受来自金属电子的活性位点,但不能提供更多的电子给Fe的3d轨道。也就是说,在B-S缓蚀剂的分子结构中再添加一个苯环并不能通过电子转移促进缓蚀剂与铁基体之间的相互作用,即随着温度的升高,苯环不能促进席夫碱缓蚀剂和金属之间的相互作用。
缓蚀剂的分子动力学模拟也证实了这一观点。分子动力学的模拟表明,随着温度的升高,缓蚀剂的吸附构型由平行吸附向倾斜吸附转变,随之变化的是缓蚀剂吸附能的升高。说明随着温度的升高,缓蚀剂与金属之间的相互作用减弱,以至于缓蚀剂不能有效的吸附在金属的表面,逐渐从金属表面解吸。与此同时,缓蚀剂的吸附构型也随之变化,其中平行吸附有助于缓蚀剂在金属表面的吸附。
3 结论
(1) B-S和BB-S缓蚀剂在HCl溶液中随着温度的升高,对N80碳钢的缓蚀效率逐渐下降。
(2) BB-S缓蚀剂中的苯环结构没有促进它与钢基体之间的相互作用,反而由于苯环较大的空间位阻以及对缓蚀剂前线轨道能级的影响,降低了BB-S缓蚀剂与钢基体之间的相互作用。
(3) 席夫碱缓蚀剂的吸附能随着温度的升高而增加,分子构型由平行吸附向倾斜吸附转变,即温度的升高降低了缓蚀剂与金属之间的相互作用。
参考文献
Synergistic effect of halide ions and gum Arabic for the corrosion inhibition of API5L X70 pipeline steel in H2SO4
[J].
Experimental and theoretical study of some N-pyridinium salt derivatives as corrosion inhibitors for mild-steel in acidic media
[J].
Effect of thiourea imidazoline quaternary ammonium salt corrosion inhibitor on corrosion of X80 pipeline steel
[J]. J.
硫脲基咪唑啉季铵盐缓蚀剂对X80管线钢腐蚀的影响
[J].
What determines the inhibition effectiveness of ATA, BTAH, and BTAOH corrosion inhibitors on copper
[J].
Quantitative structure-activity relationship model for amino acids as corrosion inhibitors based on the support vector machine and molecular design
[J].
Chitosan-cinnamaldehyde Schiff base: a bioinspired macromolecule as corrosion inhibitor for oil and gas industry
[J].
Study of the inhibition mechanism and synergistic effect of corrosion inhibitors in sweet system
[D].
二氧化碳腐蚀体系缓蚀剂的缓蚀机理及缓蚀协同效应研究
[D].
Performance evaluation and adsorption behavior of two new mannich base corrosion inhibitors
[J]. J.
两种新型曼尼希碱缓蚀剂的性能及吸附行为研究
[J].
Study of corrosion behavior of API 5L X52 steel in sulfuric acid in the presence of ionic liquid 1-ethyl 3-methylimidazolium thiocyanate as corrosion inhibitor
[J].
A new schiff base derivative as an effective corrosion inhibitor for mild steel in acidic media: Experimental and computer simulations studies
[J].
Inhibition effect of soybean meal extract on corrosion of Q235 steel in hydrochloric acid medium
[J]. J.
豆粕提取物在盐酸中对Q235钢的缓蚀性能
[J].
A theoretical and experimental study of castor oil-based inhibitor for corrosion inhibition of mild steel in acidic medium at elevated temperatures
[J].
Molecular structural aspects of organic corrosion inhibitors: influence of -CN and -NO2 substituents on designing of potential corrosion inhibitors for aqueous media
[J].
Research progress of acidizing corrosion inhibitors in oil/gas well
[J].
油气井酸化缓蚀剂研究进展
[J].
Corrosion inhibition of mild steel by ethylamino imidazoline derivative in CO2-saturated solution
[J].
Bolaamphiphile-class surfactants as corrosion inhibitor model compounds against acid corrosion of mild steel
[J].
Melamine derivatives as effective corrosion inhibitors for mild steel in acidic solution: chemical, electrochemical, surface and DFT studies
[J].
Corrosion inhibition performance of imidazoline derivatives
[J]. J.
咪唑啉类衍生物缓蚀性能研究
[J].
A novel and high-efficiency inhibitor of 5-(4-methoxyphenyl)-3h-1, 2-dithiole-3-thione for copper corrosion inhibition in sulfuric acid at different temperatures
[J].
Synthesis and comparison of two chromone based Schiff bases containing methoxy and acetamido substitutes as highly sustainable corrosion inhibitors for steel in hydrochloric acid
[J].
Corrosion inhibition and adsorption behavior of new Schiff base surfactant on steel in acidic environment: Experimental and theoretical studies
[J].
Molecular structural aspects of organic corrosion inhibitors: Experimental and computational insights
[J].
The inhibition performance of long-chain alkyl-substituted benzimidazole derivatives for corrosion of mild steel in HCl
[J].
The kinetics of inhibitor adsorption on iron
[J].
Corrosion characterization of titanium alloys by electrochemical techniques
[J].
The effect of fluoride ions on the corrosion behavior of pure titanium in 0.05 M sulfuric acid
[J].
Hydroxymethyl urea and 1, 3-bis (hydroxymethyl) urea as corrosion inhibitors for steel in HCl solution
[J].
Corrosion inhibition and adsorption behavior of green corrosion inhibitor SDDTC on AZ31B Mg-alloy
[J]. J.
绿色缓蚀剂SDDTC对AZ31B镁合金的缓蚀作用及吸附行为
[J].
Effect of akyl chain length, flow, and temperature on the corrosion inhibition of carbon steel in a simulated acidizing environment by an imidazoline-based inhibitor
[J].
Chitosan derivatives as green corrosion inhibitors for P110 steel in a carbon dioxide environment
[J].
Electrochemical and theoretical studies of adsorption and corrosion inhibition of N, N’-Bis (2-hydroxyethoxyacetophenone)-2, 2-dimethyl-1, 2-propanediimine on Low Carbon Steel (API 5L Grade B) in Acidic Solution
[J].
The synergistic corrosion inhibition study of different chain lengths ionic liquids as green inhibitors for X70 steel in acidic medium
[J].