海上油气开采勘探、钻井等环节中,装备材料的服役环境是典型的S2-、Cl-共存的海洋腐蚀环境,苛刻的海洋环境服役条件对Cu合金的耐腐蚀性提出了更高的要求。文献[3~5]研究表明,在洁净海水中,Cu-Ni合金表面能形成具有保护性的氧化膜,降低了腐蚀速率,而在含硫化物的海水中,腐蚀速率显著增加,这可能是由于S2-或硫化物与阴阳极反应的催化作用所致;ElDomiaty和Alhajji[6]研究认为,Cu-Ni合金在含S海水中发生了选择性溶解,导致高腐蚀速率;Alhajji和Reda[7]对Cu-Ni合金在不同硫化物浓度下的腐蚀行为进行研究,结果表明,Cu-Ni合金的腐蚀交换电流密度(Icorr)依赖于硫化物浓度的变化,有氧气存在条件下,合金的腐蚀速率会显著降低,搅拌会增加合金的Icorr,70%Cu-30%Ni合金的腐蚀速率受硫化物浓差极化的控制,对于90%Cu-10%Ni合金,Icorr的大小取决于电化学反应速率及腐蚀产物膜的形成速率,通过对Cu-Ni合金表面进行预氧化钝化处理,可使Icorr降低2~3个数量级;Eiselstein等[8]和De Sanchez和Schiffrin等[9]研究了铜镍合金在未污染和含硫化物的海水中的腐蚀行为,结果表明,海水中硫化物和氧的共同存在导致的腐蚀速率远远高于合金单独暴露在硫化物或氧中所测得的腐蚀速率,硫化物的存在阻止了具有钝化作用的氧化膜的形成,催化提高氧还原阴极反应速率,并促使阳极氧化反应不断发生使合金溶解。因此,硫化物的存在对Cu-Ni合金的耐腐蚀性能会产生严重影响。
铜合金在海水中耐腐蚀的优异性能通常归因于其表面形成的具有保护性的腐蚀产物膜来抵抗腐蚀性离子的渗透。Cu-15Ni-8Sn中Ni、Sn的存在使腐蚀产物中含有电子导电性低的SnO2等,提高合金表面腐蚀产物膜层电阻,改善合金的耐蚀性[10];但三元的Cu-15Ni-8Sn是典型的调幅分解强化型铜基合金,存在Sn反偏析导致材料成分不均匀问题,在基体相和析出相之间易产生严重的局部腐蚀现象[11]。目前,海水环境中S2-的存在对Cu-15Ni-8Sn合金的腐蚀行为的影响尚不清晰,Cu-15Ni-8Sn合金在S2-、Cl-共存环境中,腐蚀产物膜的微观结构、组织成分、电化学稳定性演化规律和腐蚀机理有待进一步深入研究。
本文针对目前商用的Cu-15Ni-8Sn合金分别在不含和含10 mg/L的S2-的3.5% (质量分数) NaCl溶液中的腐蚀行为和腐蚀产物膜的演变规律进行系统研究,利用静态浸泡失重实验、结合电化学测试和微观组织结构表征,分析S2-、Cl-的共存合金腐蚀行为的影响,探讨合金在S2-、Cl-共存环境下的腐蚀机理。本研究可为海洋采油平台、海底管线用铜镍锡基合金关键部件的服役安全性和使用寿命的预测与评估提供理论依据和数据支撑,对商用Cu-15Ni-8Sn合金的实际应用具有重要意义。
1 实验方法
实验所用合金为宁波博威合金材料股份有限公司生产商用时效态Cu-15Ni-8Sn合金,样品(直径20 mm、厚度3 mm)表面经400#~2000#砂纸逐级打磨后用粒度抛光后,使用丙酮和酒精超声清洗,放入干燥箱中干燥12 h。
将处理后的Cu-15Ni-8Sn合金样品在添加10 mg/LNa2S的3.5%NaCl溶液中浸泡30 d,模拟在含S2-下的海水环境,同时取相同合金样品在不含Na2S的3.5%NaCl溶液中浸泡30 d作为对照。腐蚀溶液每24 h更换一次。通过失重法计算样品在溶液中静态腐蚀1、3、5、18、30 d的腐蚀速率,计算式如
式中,v表示试样的年平均腐蚀速率,mm/a;m表示试样腐蚀前的质量,g;mt表示试样腐蚀后的质量,g;mk表示空白试样腐蚀前后的质量差,g;s表示试样总表面积,cm2,t表示浸泡时间,h;ρ表示测试试样的密度,kg/m3。
采用DH7000C电化学工作站,使用三电极体系进行电化学测试。直径为1 cm的圆盘试样为工作电极,露出0.7854 cm2的工作面积,其余用环氧树脂密封,辅助电极为铂片电极,参比电极为饱和Ag/AgCl电极。本文中的所有电位均相对于饱和Ag/AgCl电极电位。电化学测试包括电化学阻抗谱(EIS)和动电位极化测试(Tafel曲线),在测量电化学特征之前,测试开路电位(OCP) 30 min。EIS频率范围为105~0.005 Hz,交流幅值信号为5 mV。动电位极化扫描范围为相对于OCP的±0.25 V,扫描速率为1 mV/s。在两种溶液中,对每种电化学测试进行3次电化学实验。结果可重复,代表平均水平。
对样品的腐蚀产物膜层形貌采用场发射扫描电子显微镜(FE-SEM,FEI Quanta 250 FEG,分辨率1.2 nm@30 kV,配备Everhart-Thornley二次电子探测器)进行观察。通过牛津仪器X-Max80能谱分析仪(EDS)、小角度掠入射X射线衍射(XRD,Rigaku SmartLab 9 kW,Cu Kα辐射源λ = 0.15406 nm,工作电压40 kV/电流40 mA,掠入射角0.5°~5°连续可调)以及X射线光电子能谱(XPS, Thermo Scientific K-Alpha+,单色化Al-Kα射线1486.6 eV,能量分辨率0.45 eV,配备双束中和电子枪)对样品腐蚀产物膜层的化学成分、元素价态及物相组成进行综合分析。
2 实验结果
2.1 静态浸泡腐蚀失重实验
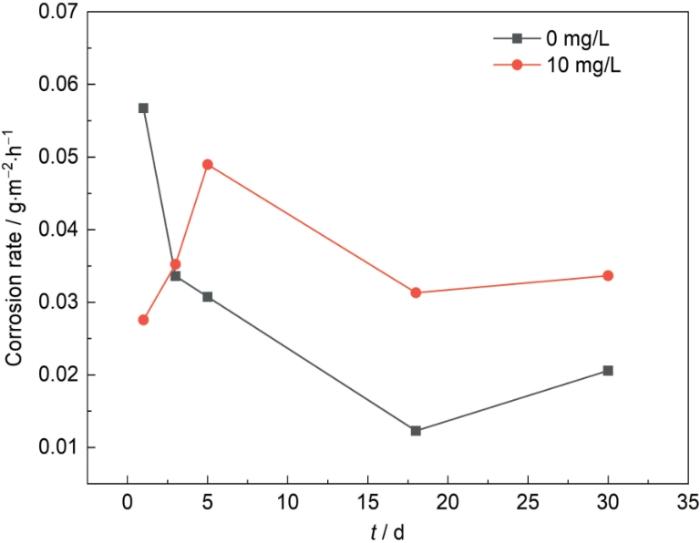
图1为Cu-15Ni-8Sn合金在不含和含10 mg/L Na2S的3.5%NaCl溶液中测得的腐蚀速率随浸泡时间的变化曲线。在不含S2-的3.5%NaCl溶液中,Cu-15Ni-8Sn合金的腐蚀速率随着浸泡时间的延长逐渐减小并趋于稳定;而在含10 mg/L Na2S的溶液中,合金的腐蚀速率在浸泡1 d后为0.02756 g·m-2·h-1,远低于在未添加S2-的溶液中(0.05674 g·m-2·h-1)的腐蚀速率;但随着浸泡时间的延长,合金在含S2-的溶液中的腐蚀速率迅速增加,在浸泡3 d后腐蚀速率为0.03523 g·m-2·h-1,接近于合金在不含S2-的溶液中的腐蚀速率;在浸泡5 d后,腐蚀速率已经大于未添加S2-的溶液中的腐蚀速率;随后随时间的延长有所减小,合金浸泡腐蚀30 d后,在含有10 mg/L Na2S的3.5%NaCl溶液中的腐蚀失重率为0.03418 g·m-2·h-1,在含有0 mg/L Na2S的3.5%NaCl溶液中的腐蚀失重率为0.02216 g·m-2·h-1。合金在添加S2-的溶液中的平均腐蚀速率仍高于在不含S2-的溶液中的平均腐蚀速率。
图1
图1
Cu-15Ni-8Sn合金浸泡在0和10 mg/L Na2S的3.5%NaCl溶液中30 d的腐蚀速率
Fig.1
Corrosion rates of Cu-15Ni-8Sn alloy during 30 d immersion in 3.5%NaCl solutions containing 0 and 10 mg/L Na2S
2.2 电化学测试分析
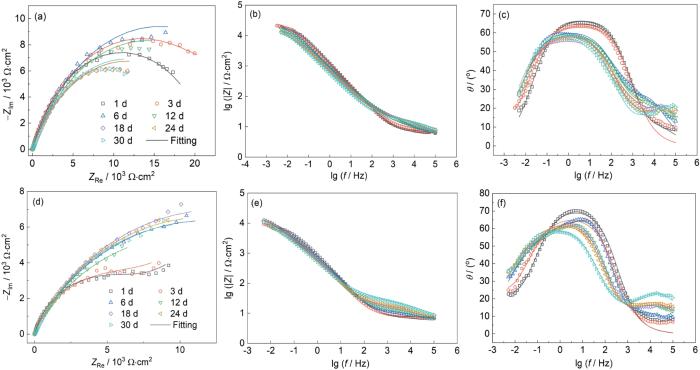
EIS测试结果显示,在无S2-溶液中,Cu-15Ni-8Sn合金的Nyquist图容抗弧半径随时间延长逐渐增大,低频区的模值也不断增加(图2)。这表明,合金表面形成的钝化膜具有良好的稳定性,并随着时间的推移逐渐增强[12]。在无S2-环境中,钝化膜能够有效阻止Cl-的进一步侵蚀,从而减缓腐蚀过程。相反,在含S2-溶液中,Nyquist图的容抗弧半径明显减小,Bode图中的模值和相角峰值也随时间的延长而降低。这表明硫化物的存在削弱了合金表面的保护膜,导致腐蚀过程加剧。随着硫化物浓度的增加,这种破坏作用更加显著。硫化物与Cu反应生成的Cu2S和CuS膜为多孔、非保护性的腐蚀产物,这些多孔结构使得Cl-能够轻易穿透膜层,直接接触到合金基体,从而加速腐蚀过程[13]。这些多孔膜不仅缺乏有效的屏障作用,还可能为进一步的腐蚀提供通道和活性点,导致腐蚀速率迅速增加。
图2
图2
Cu-15Ni-8Sn合金在含不同浓度Na2S的3.5NaCl溶液中浸泡30 d内的Nyquist图及Bode图
Fig.2
Nyquist plots (a, d) and Bode plots (b, c, e, f) of Cu-15Ni-8Sn alloy after immersion for different time in 3.5%NaCl solutions containing 0 mg/L (a-c) and 10 mg/L (d-f) Na2S
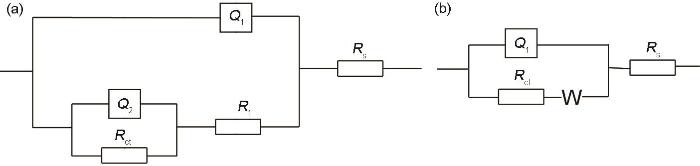
为了直观分析Cu-15Ni-8Sn合金在含与不含S2-的3.5%NaCl溶液中的腐蚀行为,使用等效电路(图3)对阻抗数据进行了拟合。在等效电路中,对于不含S2-的溶液,采用两个双电层电容图3a来拟合Cu合金在腐蚀过程中形成的双层钝化膜结构,分别为腐蚀层与腐蚀溶液间构成的电双层和基体与表面金属氧化物之间构成的电双层。对于含S2-溶液,在浸泡初期(1和3 d)观察到有Warbug扩散电阻产生,在浸泡后期(6 d后)电化学数据与合金在不含S2-的溶液中的类型相同,因此在浸泡前期采用图3b所示等效电路浸泡后期采用图3a所示等效电路。研究表明,固体电极(表面粗糙)的电双层电容的频率特性与“纯电容”并不完全一致,产生“弥散效应”。本文在等效电路中采用常相位角元件(CPE)代替纯电容[14]。
图3
图3
Cu-15Ni-8Sn合金在不同Na2S含量的3.5%NaCl溶液中浸泡时EIS拟合的等效电路图
Fig.3
Equivalent circuits diagrams for fitting EIS of Cu-15Ni-8Sn alloy immersed in 3.5%NaCl solutions with 0 mg/L Na2S for 1-30 d and 10 mg/L Na2S for 6-30 d (a), and 10 mg/L Na2S for 1-3 d (b)
其中,Rs为溶液电阻、Qf为腐蚀层电容、Rf为合金在溶液中通过腐蚀产物层的电阻,Qdl描述了双电层电容,Rct是相应的电荷转移电阻。W是Warbug扩散电阻。
表1 Cu-15Ni-8Sn合金在不添加Na2S的3.5%NaCl水溶液中浸泡不同时间后的EIS拟合参数
Table 1
| Time / d | Rs / Ω·cm2 | Qf-Y0 / Ω-1·cm-2·s n | Qf-n | Rf / Ω·cm2 | Qdl-Y0 / Ω-1·cm-2·s n | Qdl-n | Rt / Ω·cm2 |
|---|---|---|---|---|---|---|---|
| 1 | 5.696 | 5.574 × 10-5 | 0.7457 | 3.491 | 1.500 × 10-4 | 0.7578 | 2.200 × 104 |
| 3 | 7.284 | 2.397 × 10-4 | 0.7258 | 4.610 × 101 | 2.451 × 10-4 | 0.6561 | 3.743 × 104 |
| 6 | 6.042 | 9.567 × 10-5 | 0.6743 | 2.235 × 101 | 2.200 × 10-4 | 0.6959 | 3.132 × 104 |
| 12 | 5.730 | 8.860 × 10-5 | 0.6577 | 2.785 × 101 | 2.571 × 10-4 | 0.6835 | 2.835 × 104 |
| 18 | 5.326 | 7.027 × 10-5 | 0.6367 | 2.580 × 101 | 3.513 × 10-4 | 0.6762 | 2.328 × 104 |
| 24 | 5.660 | 6.378 × 10-5 | 0.6421 | 2.416 × 101 | 3.697 × 10-4 | 0.6808 | 2.302 × 104 |
| 30 | 6.022 | 6.192 × 10-4 | 0.6346 | 2.511 × 101 | 4.221 × 10-4 | 0.6935 | 2.319 × 104 |
表2 Cu-15Ni-8Sn合金在含10 mg/L Na2S的3.5%NaCl水溶液中浸泡不同时间后的EIS拟合参数
Table 2
| Time / d | Rs / Ω·cm2 | Qdl-Y0 / Ω-1·cm-2·s n | Qdl-n | Rf / Ω·cm2 | Qdl-Y0 / Ω-1·cm-2·s n | Qdl-n | Rt / Ω·cm2 | W / 10-4·Ω-1·cm-2·s1/2 |
|---|---|---|---|---|---|---|---|---|
| 1 | 7.398 | 2.654 × 10-4 | 0.8018 | - | - | - | 7.547 × 103 | 1.361 × 10-3 |
| 3 | 7.632 | 4.227 × 10-4 | 0.7660 | - | - | - | 8.231 × 103 | 1.571 × 10-3 |
| 6 | 6.006 | 3.167 × 10-4 | 0.5814 | 7.758 | 1.212 × 10-4 | 0.8843 | 2.429 × 104 | - |
| 12 | 5.372 | 3.184 × 10-4 | 0.5341 | 1.404 × 101 | 2.217 × 10-4 | 0.8255 | 2.230 × 104 | - |
| 18 | 5.738 | 2.241 × 10-4 | 0.5426 | 1.543 × 101 | 2.616 × 10-4 | 0.7874 | 2.646 × 104 | - |
| 24 | 5.821 | 2.265 × 10-4 | 0.5445 | 1.780 × 101 | 2.902 × 10-4 | 0.7809 | 2.454 × 104 | - |
| 30 | 5.102 | 1.622 × 10-4 | 0.5399 | 1.957 × 101 | 4.016 × 10-4 | 0.7275 | 2.248 × 104 | - |
在含有S2-的溶液中浸泡30 d后,尽管Cu-15Ni-8Sn合金的膜层转移电阻随时间延长而增大,但其增大的幅度和最终值(1.957 × 101 Ω·cm2)均低于不含S2- (2.511 × 101 Ω·cm2)的情况。这说明腐蚀速率虽然有所减缓,但总体仍然较高。膜层转移电阻较小表明S2-容易导致膜层结构的脆弱和不均匀,腐蚀产物膜的局部区域可能存在裂纹或孔洞,使得钝化膜无法完全覆盖合金表面,从而降低了整体的保护性能。这些缺陷可能是由于硫化物生成过程中形成的多孔结构导致的[17]。
2.3 腐蚀产物形貌分析
Cu-15Ni-8Sn合金浸泡在不同溶液中后的表面腐蚀产物SEM形貌如图4所示,可以看出,在不含S2-的3.5%NaCl溶液中,合金表面形成了一层致密而平坦的腐蚀产物膜。随着浸泡时间的延长,膜表面的颗粒逐渐增大,O和Cl的含量不断增多,而Ni和Sn的含量逐渐减少,表明在无S2-环境中,腐蚀产物膜能够有效地保护合金基体。相较之下,在含硫化物的溶液中,浸泡6 d后,O的质量分数从9%增至29.5%,S的质量分数从0.2%增至0.4%,合金基底表面形成了较完整的腐蚀产物膜,膜层表面聚集大量颗粒状腐蚀产物。随着浸泡时间延长至18 d,腐蚀产物膜出现微裂纹,O含量略有下降,浸泡30 d时,腐蚀产物膜表面裂纹显著,表明生成的腐蚀产物结构疏松,对合金基底的保护作用下降。
图4
图4
Cu-15Ni-8Sn合金浸泡在Na2S含量不同的3.5%NaCl溶液中浸泡不同时间后的表面微观形貌与成分
Fig.4
Surface micro-morphologies and elemental contents of Cu-15Ni-8Sn alloy after immersion in 3.5%NaCl solutions containing 0 mg/L (a-d) and 10 mg/L (e-h) Na2S for 1 d (a, e), 6 d (b, f), 18 d (c, g) and 30 d (d, h)
2.4 腐蚀产物横截面分析
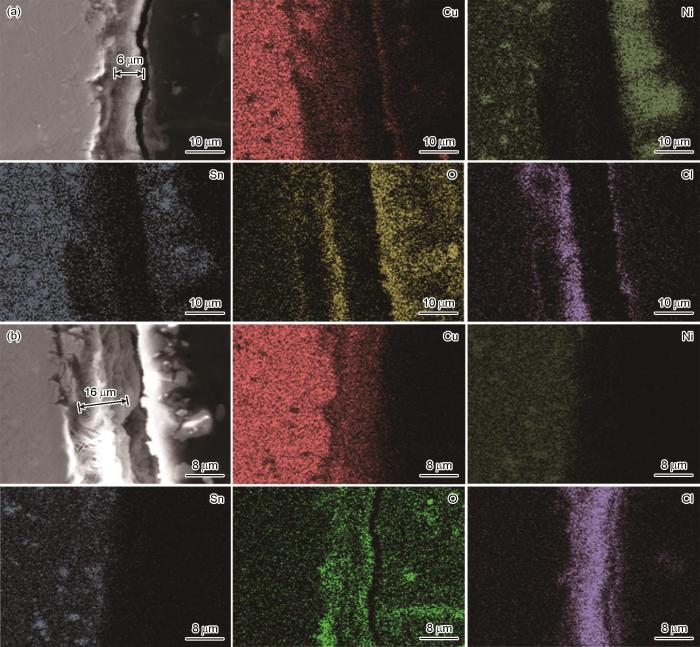
图5显示了Cu-15Ni-8Sn合金在0和10 mg/L Na2S溶液中分别浸泡30 d后的样品SEM横截面形貌和EDS图。可知,合金在0和10 mg/L的3.5%NaCl溶液中生成的腐蚀产物膜层厚度分别为6和14 μm;在不含S2-的3.5%NaCl溶液中,腐蚀产物层较为均匀,内层主要由致密的Ni和Sn的氧化物组成,这层氧化物能够有效阻止腐蚀介质的进一步渗透,保护合金基体。在含S2-的溶液中,腐蚀产物膜与基体分离,腐蚀产物呈现疏松多孔的结构,O和S主要集中在包裹合金的环氧树脂一侧。这表明,在腐蚀过程中生成的氧化物与硫化物易于结合形成疏松且易脱离的腐蚀产物,从而降低了合金的耐蚀性能。合金在两种溶液中的腐蚀产物膜微观形貌反映出的耐蚀性结果和静态腐蚀失重、电化学测试结果相一致。
图5
图5
Cu-15Ni-8Sn合金在不同含量Na2S的3.5%NaCl溶液中浸泡30 d的截面形貌和元素分布
Fig.5
Cross-sectional morphologies and element distributions of Cu-15Ni-8Sn alloy after 30 d immersion in 3.5%NaCl solutions containing 0 mg/L (a) and 10 mg/L (b) Na2S
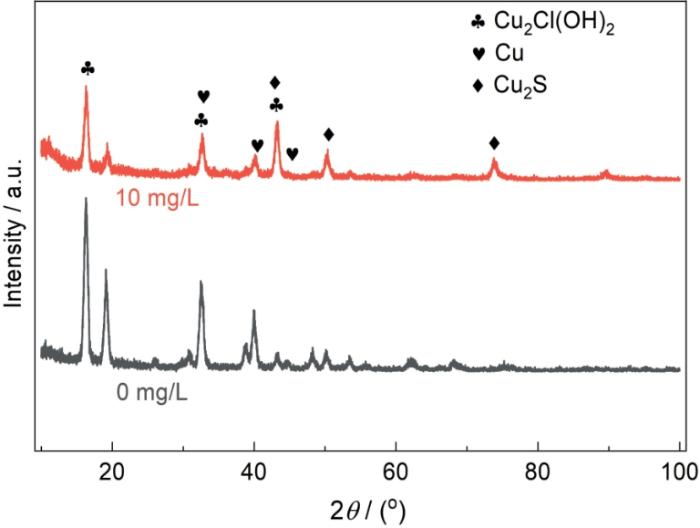
2.5 腐蚀产物XRD分析
图6
图6
Cu-15Ni-8Sn合金在含0和10 mg/L Na2S的3.5% NaCl溶液中浸泡30 d后的XRD谱
Fig.6
XRD patterns of Cu-15Ni-8Sn alloy after 30 d immersion in 3.5%NaCl solutions containing 0 mg/L and 10 mg/L Na2S
在含S2-的溶液中,初期腐蚀速率较低,是因为S2-在溶液中发生水解反应[19]:
生成HS-和OH-,在初期促进了Cu2O和其他腐蚀产物的快速形成,暂时提供了一定的保护作用。尽管在含S2-溶液中初期腐蚀速率较低,但腐蚀速率迅速增大,说明初期生成的腐蚀产物膜迅速劣化和破裂,无法提供持续的保护作用。含硫化物的腐蚀产物膜多孔且不致密,导致腐蚀介质能够快速穿透膜层,侵蚀金属基体,从而大幅增加腐蚀速率。
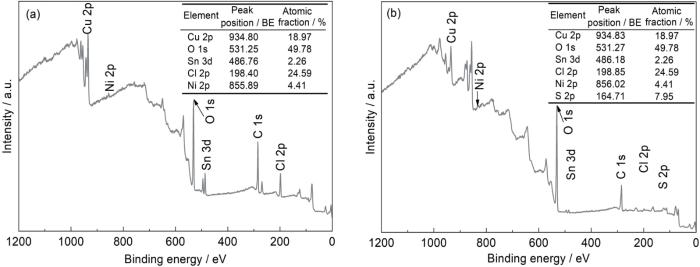
2.6 腐蚀产物的成分
Cu-15Ni-8Sn合金在含有0和10 mg/L Na2S的3.5%NaCl溶液中浸泡30 d后的腐蚀产物成分XPS全谱分析证实,Cu、Ni、Sn的氢氧化物、氧化物以及在10 mg/L条件下硫化物的存在(图7)。通过XPS峰拟合方法得到了两种腐蚀介质下Cu-15Ni-8Sn合金的Cu 2p、Ni 2p、Sn 3d和O 1s的谱图。
图7
图7
Cu-15Ni-8Sn合金在不同含量Na2S的3.5%NaCl溶液中浸泡30 d后的XPS全谱图
Fig.7
XPS full spectra of Cu-15Ni-8Sn alloy after 30 d immersion in 3.5%NaCl solutions containing 0 mg/L (a) and 10 mg/L (b) Na2S
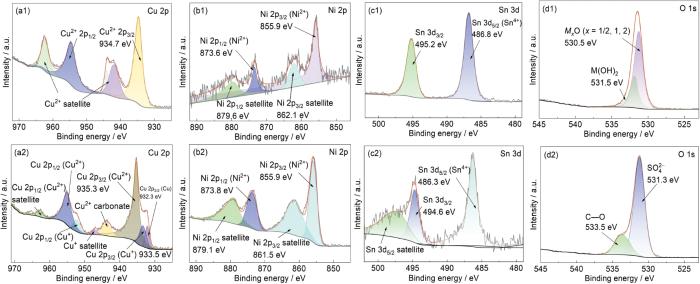
在0 mg/L Na2S条件下(图8a1),Cu 2p3/2的主峰位于934.7 eV,归属于Cu(OH)2。图8b1显示,Ni 2p3/2的主峰位于855.9 eV,归属于Ni(OH)2。图8c1中,Sn 3d5/2的主峰位于486.8 eV,归属于SnO2。图8d1中,O 1s主峰分别在530.5 和531.5 eV处,表明主要是金属氧化物和氢氧化物。结合图6的XRD分析结果可得出,Cu-15Ni-8Sn合金在不含S2-的3.5% NaCl溶液中的腐蚀产物成分为Cu2(OH)3Cl、Ni(OH)2和SnO2。正是这些产物中的Ni和Sn的致密氧化层在合金和海水界面处形成了稳定的屏障,提高了Cu-15Ni-8Sn合金的耐腐蚀性能[20]。
图8
图8
Cu-15Ni-8Sn合金在不同含量Na2S的3.5%NaCl溶液中浸泡30 d后腐蚀产物XPS图谱
Fig.8
XPS spectra of corrosion products formed on Cu-15Ni-8Sn alloy after 30 d immersion in 3.5%NaCl solutions containing 0 mg/L (a1-d1) and 10 mg/L (a2-d2) Na2S
结合图6中的XRD分析结果,可以得出,Cu-15Ni-8Sn合金在含有10 mg/L Na2S的3.5%NaCl溶液中的腐蚀产物成分复杂多样,主要包括Cu2(OH)3Cl、CuSO4、CuS、Ni(OH)2和SnS2。这些腐蚀产物呈现出多孔、非粘附和非保护性的特性,表面无法形成一个连续且致密的保护膜,相反,这些多孔结构更容易被腐蚀介质穿透,导致腐蚀过程的加剧。
2.7 腐蚀反应过程
已有研究[25]表明Cu-15Ni-8Sn在不含S2-的3.5% NaCl溶液中具有良好的耐腐蚀性和稳定性,主要由于其细小均匀的晶粒和合金表面形成的由Cu2(OH)3Cl外层和Ni、Sn的致密氧化层内层组成的钝化膜。本文主要讨论Cu-15Ni-8Sn合金在含有S2-的3.5%NaCl溶液中的化学反应过程。
3 结论
(1) 在不含S2-的3.5%NaCl溶液中,Cu-15Ni-8Sn合金的腐蚀速率随着浸泡时间的延长逐渐减小并趋于稳定,合金表面形成了一层稳定的钝化膜。腐蚀产物主要为Cu2(OH)3Cl、Ni(OH)2和SnO2,这层钝化膜能够有效地阻止Cl-的进一步侵蚀,从而使腐蚀速率逐渐减小并保持稳定。
(2) 在含硫的3.5%NaCl溶液中,S2-的加入在浸泡初期会促进产物膜的快速生成,这些产物会在一定程度上阻挡S2-和Cl-的生成,降低腐蚀速率,但是随着反应的进行,腐蚀产物成分更加复杂,主要包括Cu2(OH)3Cl、CuSO4、CuS、Ni(OH)2和SnS2。由于硫化物(Cu2S和CuS)的生成,这些腐蚀产物为多孔、非粘附和非保护性的混合物,无法形成有效的保护膜,反而增加了腐蚀点,促进电化学反应的进行,导致腐蚀介质能够快速穿透膜层,侵蚀金属基体,使得总体腐蚀速率高于不含硫的情况,硫化物的存在显著加剧了腐蚀作用。
参考文献
Microstructural effects on tension and fatigue behavior of Cu-15Ni-8Sn sheet
[J].
Electrochemical corrosion behavior of Cu-15Ni-8Sn alloy in marine microbial medium
[J].
Chaitanya Kumar K. 5-(3-Aminophenyl)tetrazole-A new corrosion inhibitor for Cu-Ni (90/10) alloy in seawater and sulphide containing seawater
[J].
Cu-Ni-Zn-Mn alloys for sulphide polluted seawater applications
[J].
The brazing effect on the corrosion mechanism of a multilayer material with Cu
[J].
The susceptibility of 90Cu-10Ni alloy to stress corrosion cracking in seawater polluted by sulfide ions
[J].
Corrosion of Cu-Ni alloys in sulfide-polluted seawater
[J].
The accelerated corrosion of Cu-Ni alloys in sulphide-polluted seawater: mechanism no.2
[J].
The flow corrosion mechanism of copper base alloys in sea water in the presence of sulphide contamination
[J].
Progress of corrosion behavior and anti-corrosion technology for typical copper-nickel alloys under marine environment
[J].
典型铜镍合金在海洋环境中腐蚀行为与防护技术研究进展
[J].
Electrochemical behaviour of rapidly solidified and conventionally cast Cu-Ni-Sn alloys
[J].
A comprehensive investigation of the electrochemical behavior of nickel-aluminum bronze alloy in alkaline solution: the effect of film formation potential
[J].
Probing passivating porous films by scanning electrochemical microscopy
[J].
Application of electrochemical impedance spectroscopy in corrosion protection
[J].
电化学阻抗谱技术在腐蚀防护中的应用现状
[J].
Revealing physical interpretation of time constants in electrochemical impedance spectra of Mg via Tribo-EIS measurements
[J].
Research and application of Cu-15Ni-8Sn elastic alloy
[J].
Cu-15Ni-8Sn弹性合金的研究与应用
[J].
Charge transfer resistance of copper and nickel thin film electrodes in nano dimensions
[J].
Accelerated corrosion of 70/30 copper-nickel alloys in sulfide-polluted seawater environment by sulfide
[J].
Research progress on catalysts for organic sulfur hydrolysis: Review of activity and stability
[J].
Dense ternary-size particles interstitial filling gradation stacking model for preparing high-quality indium tin oxide targets
[J].
Interpretation of Ni 2p XPS spectra of Ni conductors and Ni insulators
[J].
Electronic structure of Ni and Pd alloys. II. X-ray photoelectron core-level spectra
[J].
Changes in electronic structure within NiS x (0.60 < x < 1.53) compound series
[J].
Impact of chemical treatment on the surface, structure, optical and electrical properties of SnS thin films
[J].
Corrosion resistance of Cu-15Ni-8Sn alloy in seawater
[J].
Cu-15Ni-8Sn合金在海水中的耐腐蚀性研究
[J].
The corrosion behavior of copper alloys, stainless steels and titanium in seawater
[J].
Accelerated corrosion of 70/30 copper-nickel alloys in sulfide-polluted seawater environment by sulfide
[J].
Galvanic corrosion of copper-base alloys in contact with molybdenum-containing stainless steels in Arabian gulf water
[J].