铝合金密度低,抗疲劳性能较高,具有较高的比强度、比刚度,是工业中应用广泛的有色金属结构材料之一。其耐腐蚀性能[1]良好,在海洋工程中的应用也越来越广泛。其中,5083铝合金是Al-Mg系铝合金,具有极佳的成形加工、焊接性能和优良的耐腐蚀性能,在船舶、汽车、飞机、地铁、轻轨等有大量应用。铝合金表面可自发生成一层钝化膜,对基体起到保护作用,使其具有较强的耐蚀性。但是,在使用过程中,铝合金会出现不同形式的腐蚀现象[2,3]。30CrMnSiA高强钢具有良好的加工性,抗疲劳性能较高,被应用于飞机各种特殊耐磨零配件的制作。在实际应用过程中,铝合金与高强钢不可避免地会发生接触,当存在电解质溶液时,由于材料间自腐蚀电位的差异[4],极易发生电偶腐蚀[5]。沿海地区的飞机服役区域广,面临的腐蚀环境复杂,特别是在高氯和高湿度的海洋大气环境下[6],飞机结构件极易发生腐蚀[7],航空材料的耐蚀性对飞机的安全性有直接的影响。铝合金的表面极易产生钝化膜,具有较好的耐腐蚀性,但海洋大气中的阴离子[8] (主要是Cl-) 会破坏铝合金表面的钝化膜并诱发点蚀[9],从而加速铝合金的腐蚀。距离海岸线越近,大气中Cl-含量越高[10,11],铝合金的腐蚀愈严重,Cl-对铝合金具有较强的腐蚀作用。陈跃良等[12]研究了7B04铝合金和30CrMnSiA合金钢试样的电化学性能,结果表明,随着NaCl浓度增大,自腐蚀电流变大;电偶电流与阴阳极面积比和NaCl浓度有关,阴阳极面积比增大或NaCl浓度升高[13]均会导致电偶腐蚀效应增强。Yao等[14]研究了5383铝合金分别与907钢和铝青铜组成的两种电偶体系的早期电偶腐蚀平面分布,结果表明5383铝合金为阳极,907钢和铝青铜则始终为阴极受到保护;与偶接点的距离增大,电偶电流降低,且远端的电流分布较为均匀。当铝合金和低合金钢接触发生电偶腐蚀时,铝合金的自腐蚀电位低,通常作为电偶腐蚀反应的阳极,其腐蚀速率被加速,低合金钢作为阴极也会发生腐蚀,对电偶体系产生影响。在这种电偶腐蚀体系下,阴阳极的腐蚀行为及过程较复杂。目前关于电偶对中阴阳极都发生腐蚀的复杂电偶腐蚀行为的研究较少,对其电偶腐蚀机制的探讨不够深入,因此研究铝合金和高强钢的电偶腐蚀行为对材料的应用具有重要意义。
本文以5083铝合金和30CrMnSiA钢为研究对象,分析了电偶对在不同浓度NaCl溶液中电偶腐蚀行为,以及电偶对在0.6 mol/L NaCl溶液短期浸泡后的电偶腐蚀机制,为铝合金的防腐工作提供依据。
1 实验方法
实验用材料30CrMnSiA钢及5083铝合金成分如表1所示。两种合金试样都加工成10 mm×10 mm×4 mm方片。用于电化学测试的试样用铜导线焊接,环氧树脂密封,暴露的工作面积为1 cm2。两种试样的工作面用砂纸水磨至1200目,清洗,干燥,置于干燥器中备用。30CrMnSiA钢及5083铝合金电偶对试样处于电连接状态,间距为3 cm,分别浸泡在0.05、0.1、0.6和0.85 mol/L NaCl溶液中,温度为25 ℃,腐蚀周期为15 d。每天测量电偶对的电偶电流和电偶电位;在腐蚀周期为1,5,7,10和15 d时,分别测量0.6 mol/L浓度下两个电极的弱极化曲线和电化学阻抗谱。
表1 5083铝合金和30CrMnSiA钢的化学成分表
Table 1
| Material | Mg | Si | Fe | Cu | Mn | Cr | Zn | Ti | Al | C | P | Ni | Mo |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5083 Al-alloy | 4.21 | 0.26 | 0.43 | 0.05 | 0.29 | 0.13 | 0.009 | --- | Bal. | --- | --- | --- | --- |
| 30CrMnSiA | --- | 1.02 | Bal. | 0.03 | 0.92 | 0.96 | --- | 0.017 | --- | 0.31 | 0.01 | 0.04 | 0.05 |
采用CHI660E电化学工作站测试电偶对的开路电位 (OCP)、动电位极化曲线和电化学阻抗谱 (EIS)。采用三电极体系,其中试样为工作电极,饱和甘汞电极 (SCE) 为参比电极,铂片作为辅助电极,介质为NaCl溶液,试样在溶液中稳定30 min后测试开路电位1800 s,动电位极化曲线扫描区间为-300~+700 mV vs OCP,扫描速度为1 mV/s。EIS测试在开路电位下进行,扫描频率范围为105~10-2 Hz,信号幅值为10 mV。
实验进行到15 d时,取出电极,用ZEISS SUPRA 55扫描电镜 (SEM) 对试样表面的腐蚀形貌进行微观分析,并结合D/MAX-RA12KW型X射线衍射仪 (XRD) 分析腐蚀产物的物相组成。
2 结果与讨论
2.1 腐蚀形貌分析
图1和2分别是5083铝合金和30CrMnSiA钢电偶对在不同Cl-浓度溶液中腐蚀1 d后的宏观和SEM微观形貌图。由图1可知,钢表面腐蚀较轻微,而铝合金表面失去金属光泽,表面氧化膜层被破坏,说明铝合金在电偶腐蚀效应中加速腐蚀,为电偶对的阳极,钢为阴极。从SEM形貌图中可见,铝合金表面生成颗粒状和絮状腐蚀产物,在0.05和0.1 mol/L NaCl溶液中表面腐蚀程度较大,腐蚀产物层开裂;在0.6和0.85 mol/L NaCl溶液中表面分布着疏松的絮状腐蚀产物,在前一条件下的腐蚀产物有轻微地开裂,在后一条件下腐蚀程度较轻微。图3是铝钢电偶对在不同Cl-浓度溶液中腐蚀15 d后的腐蚀产物SEM图。看出,铝合金表面覆盖一层较为致密的腐蚀产物,腐蚀产物龟裂成不规则的片状;随着NaCl溶液浓度的增大,腐蚀产物层增多,外表面的腐蚀产物比较疏松,呈块状堆积,容易脱落,存在明显的裂纹。钢表面腐蚀产物大而密集,腐蚀产物覆盖在表面,呈苞状分布;随着溶液浓度增大,表面腐蚀产物有部分开裂,腐蚀程度加重。在0.85 mol/L的溶液中,外层腐蚀产物致密地覆盖着,内层腐蚀产物出现裂纹,腐蚀产物对基体的保护性下降,溶液中Cl-等含有腐蚀性的离子可以通过裂缝渗透到基体,导致腐蚀加剧。
图1
图1
5083铝合金和30CrMnSiA钢电偶对在不同Cl-浓度溶液中浸泡1 d后的宏观形貌
Fig.1
Macroscopic morphologies of the couple of 5083 Al-alloy and 30CrMnSiA steel after 1 d immersion in NaCl solutions with the Cl- concentrations of 0.05 mol/L (a), 0.1 mol/L (b), 0.6 mol/L (c) and 0.85 mol/L (d)
图2
图2
电偶对在不同Cl-浓度溶液中浸泡1 d后5083铝合金的腐蚀形貌
Fig.2
SEM surface morphologies of 5083Al-alloy in the couple after 1 d immersion in NaCl solutions with the Cl- concentrations of 0.05 mol/L (a), 0.1 mol/L (b), 0.6 mol/L (c) and 0.85 mol/L (d)
图3
图3
5083铝合金和30CrMnSiA钢在不同Cl-浓度溶液中浸泡15 d后的腐蚀形貌
Fig.3
SEM surface morphologies of 5083Al-alloy (a~d) and 30CrMnSiA steel in the couple (e~h) after 15 d immersion in NaCl solutions with the Cl- concentrations of 0.05 mol/L (a, e); 0.1 mol/L (b, f); 0.6 mol/L (c, g) and 0.85 mol/L (d, h)
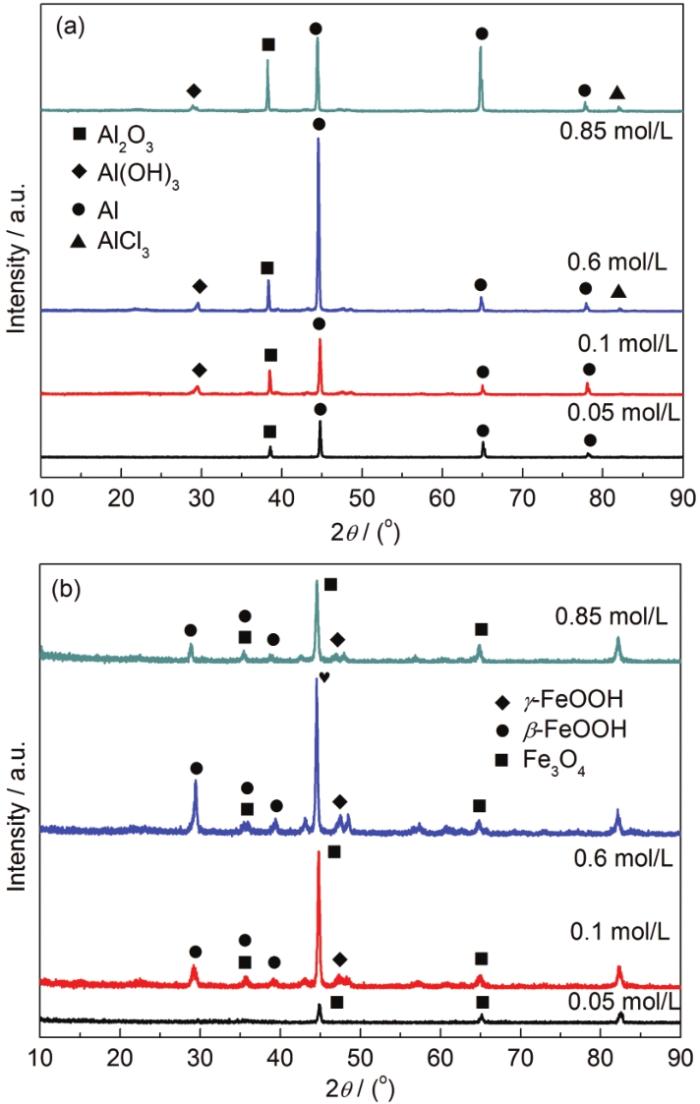
2.2 腐蚀产物分析
表2 在不同Cl-浓度溶液中浸泡15 d后的电偶对中铝合金腐蚀区域的EDS分析结果
Table 2
| Concentration / mol/L | Mg | Al | Cl |
|---|---|---|---|
| 0.05 | 1.48 | 67.67 | 2.77 |
| 0.1 | 0.11 | 43.80 | 1.85 |
| 0.6 | --- | 48.23 | 8.02 |
| 0.85 | --- | 54.53 | 4.60 |
图4
图4
5083铝合金和30CrMnSiA钢在不同Cl-浓度溶液中浸泡15 d后的腐蚀产物XRD谱
Fig.4
XRD patterns of the corrosion products formed on 5083Al-alloy (a) and 30CrMnSiA steel (b) after 15 d immersion in the NaCl solutions with different concentrations
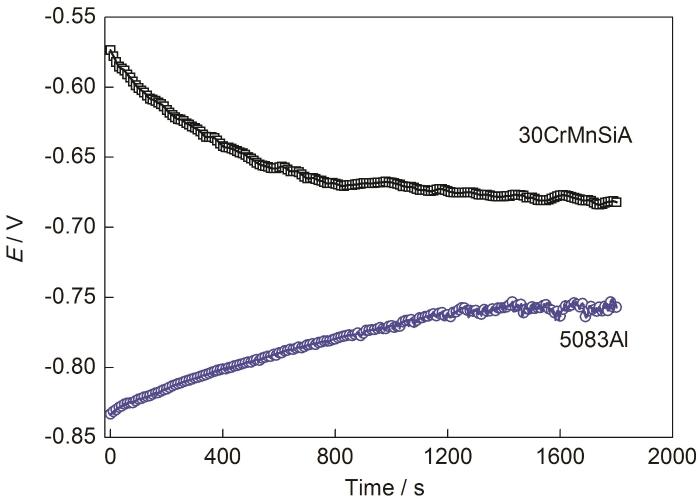
2.3 开路电位分析
图5是5083铝合金和30CrMnSiA钢在0.6 mol/LNaCl溶液中的开路电位图。钢和铝合金的开路电位分别为-0.67和-0.76 V,电位差值为90 mV,大于电偶腐蚀发生的阙值 (50 mV)。从热力学角度看,铝合金和钢组成电偶对会发生电偶腐蚀,铝合金做阳极被加速腐蚀;钢为阴极,腐蚀速率减缓,这与宏观形貌观察的结果一致。
图5
图5
5083铝合金和30CrMnSiA钢在0.6 mol/L NaCl溶液中的开路电位图
Fig.5
Open circuit potential cures of 5083Al-alloy and 30CrMnSiA steel in 0.6 mol/L NaCl solution
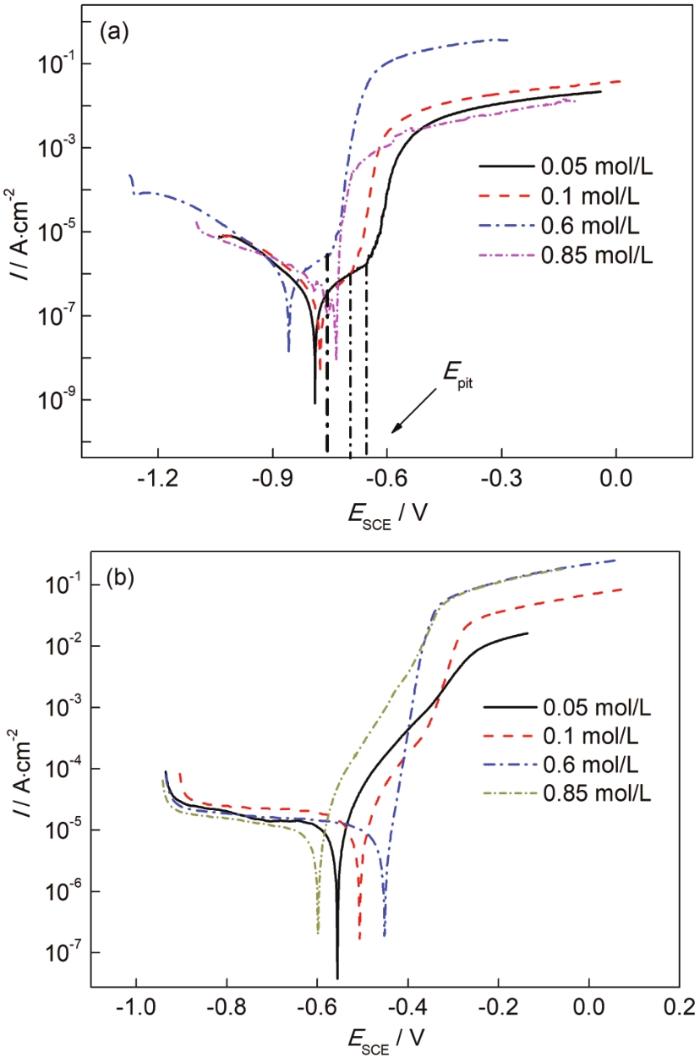
2.4 动电位极化曲线分析
图6分别为5083铝合金和30CrMnSiA钢在不同Cl-浓度下的动电位极化曲线图,表3为阴极外推法获得的电化学参数。由图6可知,当溶液浓度分别为0.05、0.1和0.6 mol/L时,极化曲线中的阴极区出现扩散特征,表示阴极反应由传质过程控制;极化曲线的阳极段出现钝化区,钝化区较窄。由表3可知,铝合金在0.05、0.1和0.6 mol/L下的点蚀电位 (Epit) 分别为-660、-700和-754 mV,而在0.85 mol/L下未出现点蚀电位。随着浓度增大,腐蚀电位 (Ecorr) 和点蚀电位都负向移动,说明随着浓度增大,5083铝合金点蚀电位降低,电极的耐蚀性降低。由钢在不同浓度下的动电位极化曲线可知,随着浓度从0.05 mol/L增加到0.6 mol/L,钢的腐蚀电位正移,腐蚀倾向降低,在0.6 mol/L时达到-452 mV (表3);在0.85 mol/L时,腐蚀电位负移,腐蚀倾向增加。钢的腐蚀电流密度在浓度为0.6 mol/L时最大,达到23.33 μA·cm-2。不同Cl-浓度的溶液对30CrMnSiA钢的腐蚀行为具有一定的影响,极化曲线中的阴极区有扩散特征,说明阴极反应过程受溶解氧含量的控制。在阳极极化区,发生阳极溶解,电流密度随过电位的增加而迅速增大,没有钝化区;随着过电位的增加,逐渐达到极限电流密度区,电流密度不在增加。
图6
图6
5083铝合金和30CrMnSiA钢在不同Cl-浓度溶液中的动电位极化曲线图
Fig.6
Potentiodynamic polarization cures of 5083Al-alloy (a) and 30CrMnSiA steel (b) in NaCl solutions with different concentrations
表3 5083铝合金和30CrMnSiA钢在不同Cl-浓度中的电化学参数
Table 3
| Concentration mol/L | Ecorr / mVSCE | Icorr / μA·cm-2 | Epit / mVSCE | |||||
|---|---|---|---|---|---|---|---|---|
| Al | Steel | Al | Steel | Al | Steel | |||
| 0.05 | -789 | -556 | 0.35 | 19.19 | -660 | --- | ||
| 0.1 | -776 | -507 | 0.57 | 19.49 | -700 | --- | ||
| 0.6 | -858 | -452 | 1.05 | 23.33 | -754 | --- | ||
| 0.85 | -733 | -599 | 0.63 | 16.07 | --- | --- | ||
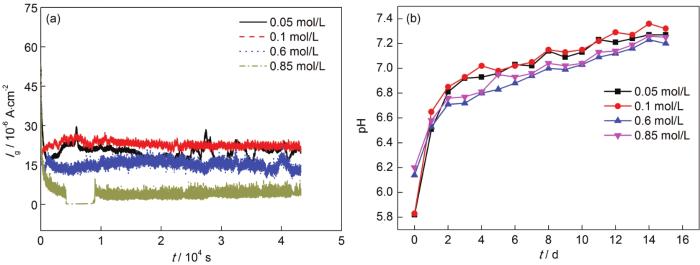
2.5 电偶电流分析
图7a是钢和铝合金电偶对在不同浓度中电偶电流密度随时间的变化曲线。由图可得,在0.05、0.1、0.6和0.85 mol/L浓度下,电偶电流密度分别为20.15,30.58,5.08以及14.12 μA·cm-2。由此可知,在0.1 mol/L浓度下电偶电流密度最大,在0.85 mol/L浓度中最小。从0.05 mol/L增大到0.1 mol/L过程中,活性Cl-具有较强的反应能力,铝合金表面的氧化膜难以稳定存在,容易被Cl-破坏,失去对基体的保护性。随着浓度进一步增大,从0.6到0.85 mol/L,Al3+进入溶液的速度减慢,抑制了铝合金的阳极极化,氧气的溶解度降低,阴极反应受到抑制,导致电偶电流密度减小。图7b是钢和铝电偶对在不同浓度下浸泡不同周期时溶液pH的变化图。由图可知,在整个电偶腐蚀过程中,溶液的pH在5~8范围内变化,溶液最初呈弱酸性,并且在腐蚀的第1 d内pH值变化趋势最大;随着周期增加,pH逐渐上升,最后稳定在7.30附近。在腐蚀周期内,0.05和0.1 mol/L NaCl溶液的pH略大于0.6和0.85 mol/L NaCl溶液的值,说明在0.05和0.1 mol/L溶液中,铝合金腐蚀溶解程度较大,反应生成Al的氢氧化物较多,导致其pH略高。
图7
图7
5083铝合金和30CrMnSiA钢电偶对在不同浓度下电偶电流密度和pH随时间的变化曲线
Fig.7
Galvanic current densities (a) and pH values (b) of 5083Al-alloy and 30CrMnSiA steel couple during immersion in NaCl solutions with different concentrations
2.6 电偶腐蚀机理分析
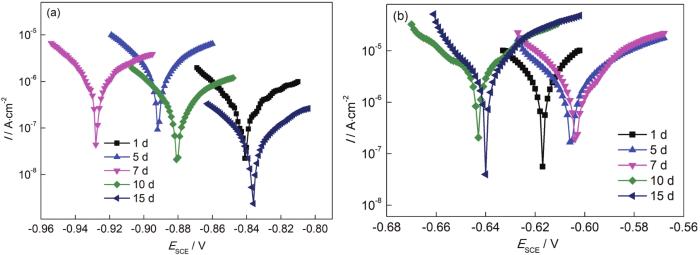
图8是5083铝合金和30CrMnSiA钢电偶对在0.6 mol/L NaCl溶液中浸泡不同时间的动电位极化曲线图,采用阴极外推法获得各极化曲线的电化学参数列于表4中。5083铝合金作为阳极,在前期铝合金加速溶解,腐蚀电流密度逐渐增加,第1 d为0.31 μA·cm-2,5 d后增大为2.37 μA·cm-2;同时其腐蚀电位逐渐负移,第7 d为-928 mV,相比第一天负移了87 mV。随着腐蚀周期的增加,铝合金表面被腐蚀产物覆盖,阻碍了Al的进一步溶解,阳极腐蚀速率减小,O的含量下降,阴极反应受到抑制。钢的腐蚀电位 (Ecorr) 在前7 d正移,7 d后电位负移,15 d后的腐蚀电位为-640 mV,小于第1 d的腐蚀电位 (-617 mV),腐蚀趋势先减小,7 d后腐蚀倾向增大;第1 d的腐蚀电流密度为4.40 μA·cm-2,15 d后的腐蚀电流密度增大到15.67 μA·cm-2,说明钢在前期作为阴极时,腐蚀速率较小;在后期腐蚀速率有所增加,钢表面产生的腐蚀产物参与了反应,形成了微电池反应。
图8
图8
5083铝合金和30CrMnSiA钢在0.6 mol/L NaCl溶液中的动电位极化曲线
Fig.8
Potentiodynamic polarization cures of 5083 Al-alloy (a) and 30CrMnSiA steel (b) after immersion in 0.6 mol/L NaCl solution for different time
表4 5083铝合金和30CrMnSiA钢在0.6 mol/L NaCl溶液中的电化学参数表
Table 4
| Material | Icorr / μA·cm-2 | -Ecorr / mVSCE | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 d | 5 d | 7 d | 10 d | 15 d | 1 d | 5 d | 7 d | 10 d | 15 d | ||
| 30CrMnSiA | 4.40 | 5.07 | 7.33 | 9.28 | 15.67 | 617 | 606 | 635 | 643 | 640 | |
| 5083 Al | 0.31 | 2.37 | 1.44 | 0.51 | 0.07 | 841 | 892 | 928 | 881 | 836 | |
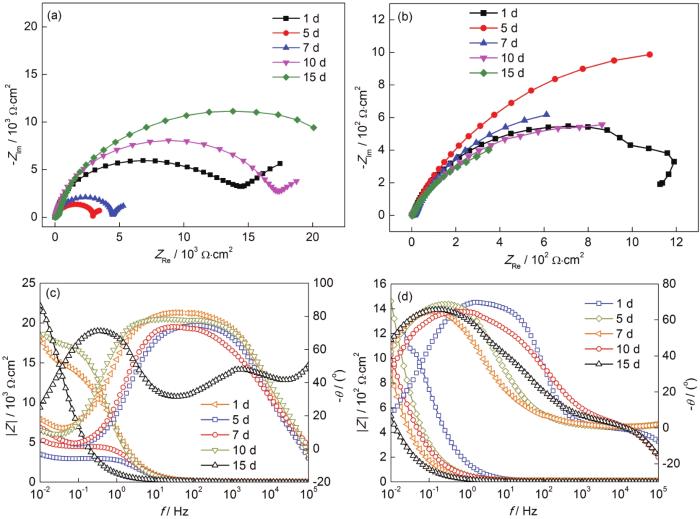
图9分别为5083铝合金和30CrMnSiA钢电偶对在0.6 mol/L NaCl溶液浸泡不同时间的Nyquist图和Bode图。铝合金的Nyquist曲线图由一个半圆弧和直线组成,高中频区表现为电荷传递控制;低频区出现Weber阻抗,说明在低频区,电极反应由表面的反应物或产物的扩散控制。整个过程由电荷传递和扩散过程共同控制。铝合金表面生成的腐蚀产物覆盖在表面,O和电荷在电极表面传输速率减小,表现为电极表面反应受扩散控制。第1 d到第5 d,铝合金阻抗谱图中容抗弧半径逐渐减小,电荷转移电阻减小,电极表面对电极反应的阻力减弱,腐蚀速率加快;第7 d到第15 d,容抗弧半径增大,电荷转移电阻增大,腐蚀速率降低。钢的阻抗谱中表现为具有一个时间常数的容抗弧,说明电极反应速率受电荷传递过程控制,容抗弧的半径大小反映了电荷传递电阻的大小,在低频区表现为电荷在电极表面传递的阻抗大小,阻抗值越大,说明电极表面的耐蚀性越好。由图可知,钢在低频区的阻抗值随着腐蚀周期的增加,其耐蚀性降低,在前期钢的阻抗值较大,第15 d时钢的阻抗值迅速下降,钢的腐蚀反应速率增加,电荷转移过程易于进行。
图9
图9
5083铝合金和30CrMnSiA钢电偶对在0.6 mol/L NaCl溶液浸泡不同周期的Nyquist图和Bode图
Fig.9
Nyquist (a, b) and Bode (c, d) plots of the galvanic coupling of 5083 Al-alloy (a, c) and 30CrMnSiA steel (b, d) after immersion in 0.6 mol/L NaCl solution for different time
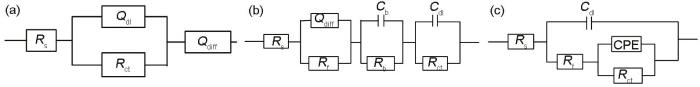
图10是用Zsimpwin软件对图9a和b进行拟合得到的等效电路图。图10a和b分别是铝合金腐蚀前期和后期的等效电路图,拟合数据见表5和6;钢腐蚀过程的等效电路图如图10c所示。图中,Rs表示溶液电阻,Q (CPE) 表示常相位角元件。指数n反映了电极表面粗糙度和偏离理想电容的程度,n=1时,元件为纯电容 (C);n=0.5时,元件为Weber阻抗(W);n=0时,元件为纯电阻 (R)。Cdl表示双电层电容,图10a中用Qdl来代替双电层电容,受电极表面不均匀性而导致偏离双电层电容。Rf为溶液与电极表面的电阻,Rct表示电荷传递电阻,Qdiff来描述传输及扩散过程。图10b是电偶腐蚀15 d后铝合金阻抗谱的等效电路图,其中Cb和Rb分别是腐蚀产物层的电容和电阻。电荷的传递速率与腐蚀电化学过程的快慢呈正相关,用Rct-1来表示腐蚀速率的快慢,Rct-1越大,腐蚀速率越快。由拟合参数可知,铝合金在前期受电偶腐蚀效应的影响腐蚀速率加快,钢的腐蚀速率受到抑制;随着电偶腐蚀的加剧,铝合金表面和钢表面都发生了不同程度的腐蚀,表面生成腐蚀产物,此时阴极反应的电荷传递速率受阻,铝合金的阳极溶解速率降低;电偶腐蚀进行到15 d时,钢表面的电荷传递电阻减小,腐蚀速率增大,铝合金阳极腐蚀反应速率加快。
图10
图10
30CrMnSiA钢及5083铝合金阻抗谱的等效电路图
Fig.10
Equivalent circuit models of EIS of 5083Al-alloy and 30CrMnSiA steel (a) Initial stage for 5083 Al-alloy, (b) final stage for 5083 Al-alloy, (c) for 30CrMnSiA steel
表5 5083铝合金阻抗谱拟合的等效电路参数
Table 5
| Time d | RsΩ·cm2 | Yo,1S sn·cm-2·105 | n1 | RctΩ·cm2 | Yo,2S sn·cm-2·10-3 | n2 | Yo,1S sn·cm-2·10-4 | RfΩ·cm2 | CbμF·cm-2 | RbkΩ·cm2 | CdlμF·cm-2 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2.077 | 2.289 | 0.94 | 13390 | 1.15 | 0.72 | --- | --- | --- | --- | --- |
| 5 | 3.099 | 2.981 | 0.88 | 3100 | 17.66 | 0.92 | --- | --- | --- | --- | --- |
| 7 | 3.355 | 2.479 | 0.92 | 4317 | 2.93 | 0.45 | --- | --- | --- | --- | --- |
| 10 | 1.773 | 2.66 | 0.92 | 7060 | 1.67 | 0.62 | --- | --- | --- | --- | --- |
| 15 | 84.56 | --- | 0.55 | 2072 | --- | --- | 1.703 | 339 | 294.5 | 22.52 | 378.8 |
表6 30CrMnSiA钢阻抗谱拟合的等效电路参数
Table 6
| Time d | RsΩ·cm2 | CdlμF·cm-2 | RfΩ·cm2 | Yo,1S sn·cm-2·10-4 | n1 | RctΩ·cm2 |
|---|---|---|---|---|---|---|
| 1 | 4.187 | 565.9 | 50 | 9.30 | 0.75 | 1311 |
| 5 | 8.539 | 415.5 | 108.7 | 41.23 | 0.79 | 3003 |
| 7 | 9.151 | 555.3 | 26.39 | 74.45 | 0.75 | 2483 |
| 10 | 1.675 | 387.6 | 13.72 | 45.52 | 0.71 | 2135 |
| 15 | 1.675 | 844.3 | 13.41 | 121.9 | 0.72 | 1871 |
2.7 电偶腐蚀机制讨论
5083铝合金和30CrMnSiA钢组成的电偶对浸泡在0.6 mol/L NaCl溶液中时,会发生电偶腐蚀,铝合金作阳极,发生金属的溶解加速反应;钢为阴极,腐蚀速率减缓,电极反应如下:
阳极反应:
在30CrMnSiA钢上发生阴极反应,以氧的还原反应为主:
随着铝合金的溶解,表面生成铝的氧化物,反应如下:
铝合金表面的氧化膜被Cl-等活性离子破坏,发生点腐蚀,腐蚀速率增大,表面主要生成絮状疏松的Al(OH)3及白色颗粒状的Al2O3。钢自身也发生电化学腐蚀,阳极反应如下:
钢的阴极反应如反应 (2),表面生成Fe(OH)2,反应如下:
在氧含量充足的条件下,Fe3O4可以转化为FeOOH[18],阳极反应如下:
阴极发生O的还原反应,反应式如 (2)
总反应为:
由此可知,当铝合金表面腐蚀产物膜稳定存在对基体产生保护作用时,同时钢的表面覆盖了低价态的腐蚀产物,铝合金的腐蚀速率降低;腐蚀15 d后,钢上腐蚀产物作为去极化剂参与电极反应,此时钢的腐蚀速率增大,钢的电荷传递电阻减小。
3 结论
(1) 5083铝合金和30CrMnSiA钢组成电偶对时,5083铝合金作为阳极被加速腐蚀,30CrMnSiA钢作为阴极腐蚀速率减缓;电偶对在0.05和0.1 mol/L NaCl溶液中的腐蚀程度大于在0.6和0.85 mol/L NaCl溶液中的;随着浓度增大,Cl-的活性减弱,溶解氧含量降低,阴极反应速率下降。
(2) 电偶对腐蚀过程中,铝合金的耐蚀性先降低再增大,前期铝合金受电偶腐蚀的影响溶解加速,随着表面腐蚀产物的增加,铝合金表面生成的腐蚀产物抑制了铝合金的溶解;钢的腐蚀速率前期较小,随着腐蚀时间的增加腐蚀速率增大;在腐蚀15 d后,钢的腐蚀产物参与阴极反应,电荷传递速率加快,导致铝合金和钢的耐蚀性降低,腐蚀速率增大。
参考文献
Effects of pH and chloride concentration on pitting corrosion of AA6061 aluminum alloy
[J].
The study of intergranular corrosion in aircraft aluminium alloys using X-ray tomography
[J].
Effects of testing variables on stress corrosion cracking susceptibility of Al 2024-T351
[J].
Galvanic corrosion in the systems titanium/316 L stainless steel/Al brass in Arabian Gulf water
[J].
The influence of temperature on the galvanic corrosion of a cast iron-stainless steel couple (prediction by boundary element method)
[J].
Mechanism of galvanic corrosion of coupled 2024 Al-alloy and 316L stainless steel beneath a thin electrolyte film studied by real-time monitoring technologies
[J]. J.
实时监测技术研究薄液膜下电偶腐蚀的机理
[J].
Galvanic corrosion of aircraft components in atmospheric environment
[J]. J.
大气环境中飞机构件的电偶腐蚀研究
[J].
Influence of environmental factors on atmospheric corrosion of aluminum alloys and its dynamic time dependence
[J].
环境因素对铝合金大气腐蚀的影响及其动态变化规律研究
[J].
Corrosion behavior of 5052 and 6061 aluminum alloys in deep ocean environment of South China Sea
[J].
5052和6061铝合金在中国南海深海环境下的腐蚀行为研究
[J].
Study on atmospheric corrosion of aluminium and its alloy at different distance away from seashore in wannine maring environments
[J].
万宁地区铝及铝合金不同距海点的大气腐蚀研究
[J].
Cl- sedimentation rate in atmosphere of tropical island
[J].
热带海岛大气中氯离子沉降速率
[J].
Short-term electrochemical corrosion behavior of 7B04 aluminum alloy and 30CrMnSiA Steel
[J].
7B04铝合金和30CrMnSiA钢短期腐蚀的电化学行为研究
[J].
Validation of predictive model for galvanic corrosion under thin electrolyte layers: An application to aluminium 2024-CFRP material combination
[J].
Early stage galvanic corrosion of 5383Al alloy coupled with 907 steel and aluminum bronze in 3.5% NaCl solution
[J].
5383铝合金与907钢和铝青铜早期电偶腐蚀的平面分布
[J].
The role of rusts in corrosion and corrosion protection of iron and steel
[J].
Study of the catalytic and cooperating action of Fe(Ⅱ) in the process of transformation from Fe(OH)2 to γ-FeOOH
[D].
Fe(Ⅱ) 在空气氧化Fe(OH)2形成γ-FeOOH过程中的协同催化作用
[D].
Role of Fe oxides in corrosion of pipeline steel in a red clay soil
[J].
Evolution of corrosion of MnCuP weathering steel submitted to wet/dry cyclic tests in a simulated coastal atmosphere
[J].