Fabrication of self-cleaning super-hydrophobic nickel/graphene hybrid film with improved corrosion resistance on mild steel
1
2017
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Corrosion of buried metal pipelines in alkaline soil media
1
2014
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
埋地金属管道在碱性土壤介质中的腐蚀
1
2014
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Rechargeable metal-metal alkaline batteries: recent advances, current issues and future research strategies
1
2023
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Design and performance of molybdenum-cobalt-vanadium polymetallic composite materials for hydrogen production by alkaline water electrolysis
1
2024
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
钼-钴-钒多金属复合材料设计及碱性电解水制氢性能
1
2024
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Noble metal-modified copper surfaces for alkaline condition hydrogen evolution reaction
1
2024
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Metal-based cathodes for hydrogen production by alkaline water electrolysis: review of materials, degradation mechanism, and durability tests
1
2024
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Design and electrochemical corrosion behavior of Zr-Ti-Ni-Cu-Be high entropy bulk metallic glasses
1
2019
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Zr-Ti-Ni-Cu-Be系高熵非晶合金设计及电化学腐蚀行为
1
2019
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Investigation of the corrosion resistance of alkaline electroless nickel plating on aluminum alloy
1
2009
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
6063铝合金碱性化学镀镍耐腐蚀性能研究
1
2009
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Electrochemical corrosion properties of Cu72Sn10-P10Ni8 amorphous ribbon
1
2015
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Cu72Sn10P10Ni8非晶薄带的电化学腐蚀性能
1
2015
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Corrosion behavior of Ti-Zr based bulk amorphous alloys in NaOH solution
1
2016
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Ti-Zr基块体非晶合金在NaOH溶液中的腐蚀研究
1
2016
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Correlation between boson peak and thermal expansion manifested by physical aging and high pressure
1
2022
... 腐蚀是金属材料在服役中常见的失效方式之一,金属的腐蚀不仅会给社会带来巨大损失,也会给工程实际带来未知的风险[1].金属材料在碱性环境中被广泛使用,如埋在碱性土壤使用的金属管道[2],具有较长的使用寿命的金属碱性电池[3],用于碱性电解水催化剂的Mo-Co-V多金属复合材料[4],用于碱性析氢反应的电催化剂的铜基材料等[5].碱性环境中的OH-能与金属表面上的金属离子发生反应,导致金属表面出现腐蚀、生锈等现象,从而降低金属材料的服役性能,并带来潜在危险[6],因此,需要进一步研究金属材料在碱性介质中腐蚀行为和腐蚀机理以满足工程实际需求.研究表明,锆基非晶合金在1 mol/L的NaOH溶液中的腐蚀电流密度(Icorr)约是304L不锈钢的1/4,且钝化区间平均在0.75 V左右,而304L不锈钢的平均钝化区间仅有0.256 V,表明锆基非晶合金拥有更好的耐腐蚀能力[7].铝合金在1 mol/L的NaOH溶液中的腐蚀电位(Ecorr)为-1.5 V,而铜基非晶的Ecorr为-0.5 V,明显高于铝合金,而Ecorr越高说明耐腐蚀性越好,表明铜基非晶合金耐腐蚀性优于铝合金[8,9].索忠源等[10]研究了TiZr基非晶合金和304不锈钢在NaOH溶液中的腐蚀行为,结果表明,在NaOH溶液中TiZr基非晶合金表现出良好的耐腐蚀性,耐腐蚀性明显优于304不锈钢.相对于不锈钢、铝合金等晶态合金,非晶合金由于其没有位错、晶界等缺陷,表现出优异的耐腐蚀性能[11],在碱性服役环境下可以减少腐蚀和氧化的风险,能更好地保持其服役性能.因此,研究非晶合金在碱性服役环境下的腐蚀行为和机理具有重要的科学意义和工程指导价值. ...
Influence of temperature on corrosion behavior of five kinds of metal in thick alkali solution
1
2007
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
温度对5种金属在浓碱中腐蚀行为的影响
1
2007
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Electrochemical corrosion behavior of 10# carbon steel in NaOH solution
1
2018
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
10号碳钢在NaOH溶液中的腐蚀电化学行为
1
2018
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Corrosion behavior of alloy AA6063-T4 in HCl and NaOH solutions
1
2018
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Effect of inhibitors on corrosion of gadolinium in water
1
2005
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
缓蚀剂对金属钆在水介质中腐蚀行为的影响
1
2005
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Studies on the structural relaxation and corrosion behavior of a Zr-based bulk metall glass
1
2014
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Zr基金属玻璃的结构弛豫和腐蚀行为研究
1
2014
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Electrochemical corrosion behaviors of amorphous Co69Fe4.5Ni1.5Si10B15 alloy
1
2011
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Corrosion behaviors of bulk amorphous Fe41Co7Cr15Mo14C15B6Y2 alloy in NaOH solution
1
2010
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
铁基块体非晶合金在NaOH溶液中的腐蚀行为
1
2010
... 除了材料结构本身的内在原因,金属材料的腐蚀与服役环境的溶液介质有关,亦与服役环境条件如温度、浓度、粗糙度和腐蚀时间等因素有关.研究表明,不锈钢、Q235钢、钛合金、纯钛和铸铁等工程实际常用的金属材料在NaOH溶液中随着温度的升高,腐蚀程度会随之加剧,铸铁的腐蚀电流密度受温度影响较大,而Ti和钛合金的腐蚀电流密度受温度影响相对较小,致钝电位较低[12].碳钢的耐腐蚀能力随着NaOH溶液温度和浓度的升高而降低[13].AA6063-T4合金在0.1 mol/L的NaOH溶液中的腐蚀对比同浓度的HCl溶液较为均匀,且腐蚀速率随着表面粗糙度的增加而增加[14].用失重法研究钆制钢的耐腐蚀性能,其在水中的腐蚀速度为0.152 g·m-2·h-1,而在NaOH溶液中浸泡8880 h后,表面仍然呈现金属光泽,没有失重与点蚀发生[15].李凤鲜[16]对锆基非晶合金在5 mol/L的NaOH、HCl、NaCl和H2SO4溶液中进行了浸泡失重实验,得出锆基非晶合金在NaOH、H2SO4、NaCl和HCl溶液的耐腐蚀性依次降低.Kim和Jang[17]研究了在HCl + NaOH溶液中温度梯度为15~55 ℃下钴基非晶合金的耐腐蚀性,结果表明,随着温度的升高和pH的下降,合金的耐腐蚀性降低.王莉和晁月盛[18]研究表明,铁基非晶合金在不同浓度的NaOH溶液中都具有较好的耐蚀性,阳极极化曲线表现出明显的钝化特征,同时随着NaOH溶液浓度的增大,铁基非晶合金耐蚀性能逐渐下降.目前的研究工作都表明了非晶合金在NaOH溶液中表现出优异的耐腐蚀性能,然而对于非晶合金随着外在环境条件的改变,系统的研究其腐蚀行为和腐蚀机理研究较少. ...
Equilibrium viscosity and structural change in the Cu47.5Zr45.1Al7.4 bulk glass-forming liquid
1
2020
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
3D printing of Zr-based bulk metallic glasses and components for potential biomedical applications
0
2019
Strain aging in metallic glasses
1
2022
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Comparison of corrosion resistance of Zr-based amorphous alloys and traditional alloys in seawater
1
2024
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
锆基非晶合金与传统合金在海水中的耐腐蚀性能对比研究
1
2024
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Effect of oxygen impurity on corrosion behavior of a Zr-based bulk metallic glass in 0.5 M H2SO4 and 0.5 M NaOH solutions
1
2023
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Corrosion behaviors of Zr-based metallic glass Zr0.55Cu0.30Al0.10Ni0.05)99Y1
1
2018
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
(Zr0.55Cu0.30Al0.10Ni0.05)99Y1非晶合金的腐蚀行为
1
2018
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Corrosion behavior of Zr55Al10Cu30Ni5 amorphous alloy in NaOH solution
1
2003
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Zr55Al10Cu30Ni5非晶合金在NaOH溶液中的腐蚀行为
1
2003
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Progress and application of Zr-based amorphous alloys
1
2003
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
锆基非晶合金的研究进展与应用
1
2003
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Behavior and mechanism of catalytic degradation of dyes by CuZr-based metallic glasses and derivative nanocomposites
1
2022
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
CuZr基非晶合金及衍生纳米复合物催化降解染料的行为与机制研究
1
2022
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Biocompatibility of Ti35-Nb3Zr2Ta, a new beta-titanium alloy, as joint prosthesis material
1
2015
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
新型β钛合金Ti35N3Zr2Ta在人工关节假体应用中的生物相容性
1
2015
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
Surface modification of Ti40Cu40Zr11Fe3Sn3Ag3 amorphous alloy for enhanced biocompatibility in implant applications
1
2024
... 锆基非晶合金是较典型的非晶合金体系之一,具有良好的玻璃形成能力和耐腐蚀性能,优异的力学、物理和化学性能[19~21].目前,关于锆基非晶合金的耐腐蚀性能的研究报道,大部分是其在海水和酸溶液中的腐蚀性能,而对于其在碱性条件下腐蚀行为的研究则相对较少.马晓伟等[22]研究了锆基非晶合金与传统合金的耐腐蚀性,表明在3.5% (质量分数) NaCl溶液中,相较于304不锈钢和6082铝合金,非晶合金表现出更加优异的耐腐蚀性能.Jiang等[23]研究了O杂质对锆基非晶合金在H2SO4溶液和NaOH溶液中腐蚀行为的影响,结果表明,O杂质对在H2SO4溶液中的腐蚀情况没有影响,但在NaOH溶液中通过抑制阴极反应,提高了耐腐蚀性.汤迦南等[24]研究了锆基非晶合金的腐蚀行为,得出该合金在3.5%NaCl溶液中自腐蚀电位最低,耐腐蚀性最差,其次是1 mol/L的NaOH溶液,而在1 mol/L的H2SO4溶液中的耐腐蚀性最好.Wang等[25]研究Zr55Al10Cu30Ni5合金在NaOH溶液中的腐蚀行为,得出该合金在NaOH溶液中具有非常好的耐蚀性,表现出钝化特性,而且钝化电位区间很宽,钝化电流密度较低.电化学阻抗受NaOH浓度的影响很小,在各种浓度下都表现为单容抗弧.锆基非晶合金在碱性条件下具有一些重要应用,由于其高抗腐蚀性和稳定性,可用作碱性电池电解质中的电极材料或催化剂[26],在节能减排方面对有机污染物降解也有应用[27],也可用于生物医疗器械的制造,如人工关节[28]、植入物[29]等,还可用于制造碱性环境下的环境监测设备,如碱性废水处理设备中的传感器和电极.因不同环境应用需求,因此研究服役环境改变对锆基非晶合金的腐蚀性能的影响很有必要.本实验采用自然浸泡法测量锆基非晶合金在不同浓度NaOH溶液中的腐蚀速率,利用电化学实验、扫描电镜(SEM)、能谱分析(EDS)以及X射线光电子能谱(XPS)分析较为系统地研究不同温度、浓度、粗糙度和浸泡处理对该合金在NaOH溶液中的腐蚀行为和腐蚀性能的影响,并探讨腐蚀机理,有助于深入了解锆基非晶合金在碱性溶液中的耐腐蚀性能和应用前景,并为新能源等多领域的材料选择和设计提供依据. ...
1
2007
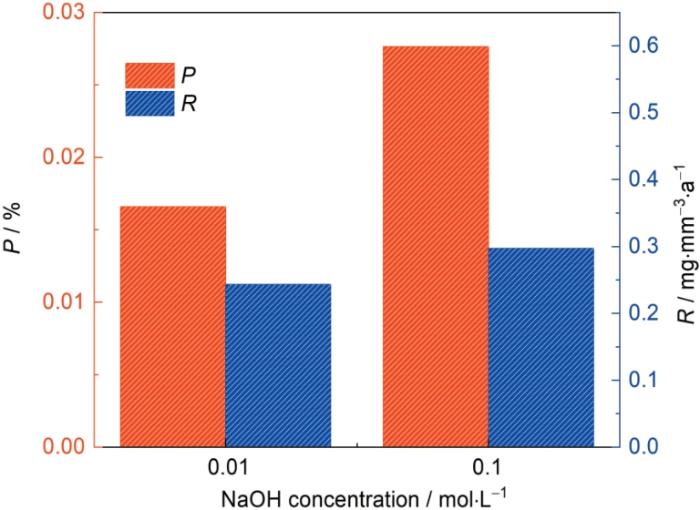
... 式中,mn 为第n次称重的质量(mg),V为该样品的体积(mm3),t为浸泡时间(a).从图1知,Vit1在0.01、0.1 mol/L的NaOH溶液中浸泡648 h后的P分别是0.017%和0.028%,R分别是0.243和0.297 mg/(mm3·a),在0.1 mol/L的NaOH溶液中的自然腐蚀速率是在0.01 mol/L的NaOH溶液中的自然腐蚀速率的1.22倍.反应速率理论表明,在恒定温度下,反应物浓度的增加能够提高分子碰撞的频率和有效碰撞的次数,因此反应速率会随之增大.而活化分子浓度与反应物浓度和活化分子百分数有关系:活化分子浓度=反应物浓度×活化分子百分数.在恒定温度下,反应物的活化分子百分数是一定的,通过增加反应物浓度,可增加活化分子浓度,使得单位时间内分子有效碰撞的次数随之增多,因而反应速率加快[30].根据反应速率理论,在0.1 mol/L的NaOH溶液中,Vit1中金属阳离子与OH-反应速率更快,因而其腐蚀速率大于在0.01 mol/L的NaOH溶液中的,表明Vit1在NaOH溶液中,随着溶液浓度的增加,其耐腐蚀性能下降. ...
1
2007
... 式中,mn 为第n次称重的质量(mg),V为该样品的体积(mm3),t为浸泡时间(a).从图1知,Vit1在0.01、0.1 mol/L的NaOH溶液中浸泡648 h后的P分别是0.017%和0.028%,R分别是0.243和0.297 mg/(mm3·a),在0.1 mol/L的NaOH溶液中的自然腐蚀速率是在0.01 mol/L的NaOH溶液中的自然腐蚀速率的1.22倍.反应速率理论表明,在恒定温度下,反应物浓度的增加能够提高分子碰撞的频率和有效碰撞的次数,因此反应速率会随之增大.而活化分子浓度与反应物浓度和活化分子百分数有关系:活化分子浓度=反应物浓度×活化分子百分数.在恒定温度下,反应物的活化分子百分数是一定的,通过增加反应物浓度,可增加活化分子浓度,使得单位时间内分子有效碰撞的次数随之增多,因而反应速率加快[30].根据反应速率理论,在0.1 mol/L的NaOH溶液中,Vit1中金属阳离子与OH-反应速率更快,因而其腐蚀速率大于在0.01 mol/L的NaOH溶液中的,表明Vit1在NaOH溶液中,随着溶液浓度的增加,其耐腐蚀性能下降. ...
Synthesis of Fe-Cr-Mo-C-B amorphous coating with high corrosion resistance
1
2012
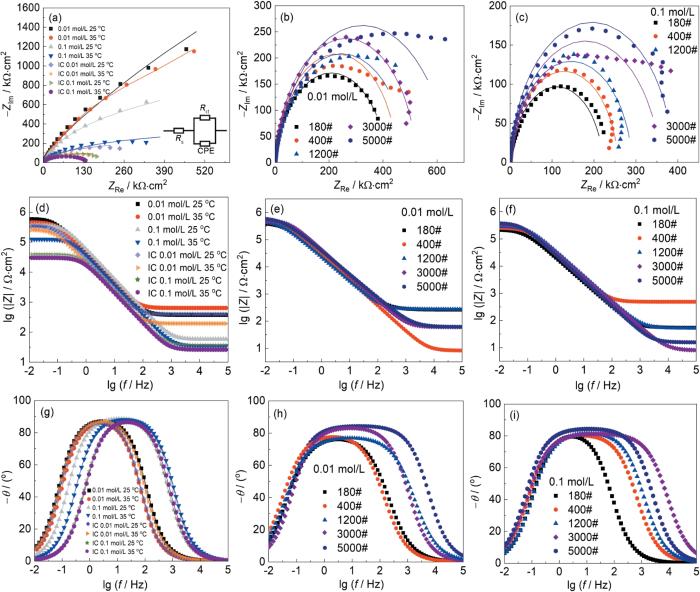
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Study of conductivity characteristics of ternary solutions KI/LiCl/LiBr-water-ethanol
1
2017
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
KI/LiCl/LiBr-水-乙醇三元体系电导率特性研究
1
2017
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Activation energies and the Arrhenius equation
1
1985
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Measurement of the relationship between conductivity of salt solution and concentration and temperature
1
2010
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
盐溶液电导率与浓度和温度的关系测量
1
2010
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Erosion corrosion characteristics of X80 pipeline steel in two-phase flow under the influence of multiple factors
1
2021
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
多因素影响下的X80管道钢两相流冲蚀腐蚀特性
1
2021
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Research progress of oxygen reduction catalytic materials and catalytic active sites
1
2019
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
氧还原催化材料与催化机理及活性位点的研究进展
1
2019
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Variation of free corrosion potential of several metallic materials in natural seawater
1
2019
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
金属材料在天然海水中的腐蚀电位及其变化规律
1
2019
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Review on electrochemical detection techniques for corrosion of reinforcing steel in concrete
1
2010
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
钢筋混凝土腐蚀的电化学检测研究现状
1
2010
... 自腐蚀电流密度反映了腐蚀速率的大小,自腐蚀电流密度越小,表明腐蚀速率越慢,耐腐蚀性越好[31].只改变温度(图2a和表1),在0.01和0.1 mol/L NaOH溶液中,25 ℃下Vit1的自腐蚀电流密度分别是其在35 ℃下的72%和82%;而25 ℃下浸泡处理后的Vit1的自腐蚀电流密度分别是其在35 ℃下的77%和92%.温度升高,Vit1的自腐蚀电流密度随之增大,表明其耐腐蚀性降低,因为温度升高会提高电解质溶液的导电性,这有助于电子和离子在金属表面之间更快速地传递,促进电化学反应的进行[32].依据Arrhenius公式[33],温度升高通常会增加反应速率,因为它提高了分子间的碰撞频率和能量,使得更多的分子克服活化能,电化学腐蚀反应加快,从而提高了整体腐蚀速率.只改变浓度(图2a和表1),在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.28倍,在35 ℃下,前者是后者的0.32倍.经过浸泡处理后,在25 ℃下,Vit1在0.01 mol/L NaOH溶液中的自腐蚀电流密度是其在0.1 mol/L NaOH溶液中的自腐蚀电流密度的0.074倍,35 ℃下,前者是后者的0.089倍.图2a和b结果皆表明随着浓度增加,Vit1的自腐蚀电流密度随之增大,Vit1的耐腐蚀性随之降低,因为NaOH属于强电解质,强电解质溶液浓度增加,溶液中的载流子数量增多,电导率增加,溶液中的离子在电场中更容易移动,高电导率会加速电化学反应的进行[34].根据Arrhenius方程,浓度升高意味着单位体积中有更多的反应物分子,导致更频繁的碰撞,提高腐蚀反应速率,加速腐蚀.改变粗糙度(图2b和表1),在0.01 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.14倍,是粗糙度1200# Vit1的2.05倍,是粗糙度3000# Vit1的5.32倍,是粗糙度5000# Vit1的9.60倍.在0.1 mol/L条件下,粗糙度180# Vit1的自腐蚀电流密度是粗糙度400# Vit1的1.35倍,是粗糙度1200# Vit1的1.98倍,是粗糙度3000# Vit1的3.19倍,是粗糙度5000# Vit1的9.14倍.粗糙度越高会导致Vit1非晶合金表面变得越不平整,暴露的表面面积增大.根据电化学腐蚀基本原理,腐蚀反应发生在材料的表面,表面越粗糙,暴露的有效表面积越大,腐蚀反应的总速率也会增大[35],所以粗糙表面的Vit1在NaOH溶液中的自腐蚀电流密度高于光滑表面的Vit1.对比未浸泡和浸泡处理的自腐蚀电流密度,在0.01 mol/L-25 ℃条件下,浸泡处理后的Vit1自腐蚀电流密度是未浸泡处理的Vit1自腐蚀电流密度的2.38倍;在0.01 mol/L-35 ℃条件下,前者是后者的2.25倍;在0.1 mol/L-25 ℃条件下,前者是后者的8.98倍;在0.1 mol/L-35 ℃条件下,前者是后者的8.07倍.浸泡处理后腐蚀情况更加严重,因为长时间浸泡后,可能在Vit1表面形成了一些活性位点,在电化学腐蚀中起到催化作用,加速了腐蚀[36].浸泡处理后导致Vit1表面发生变化,形成氧化物或其他化合物,使Vit1表面更容易发生电化学反应.表1中自腐蚀电流密度表明,在温度、浓度和浸泡处理对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-25 ℃ > 0.01 mol/L-35 ℃ > IC 0.01 mol/L-25 ℃ > IC 0.01 mol/L-35 ℃ > 0.1 mol/L-25 ℃ > 0.1mol/L-35 ℃ > IC 0.1 mol/L-25 ℃ > IC 0.1 mol/L-35 ℃.粗糙度对Vit1的耐腐蚀性影响研究中耐腐蚀性由强到弱对应的实验条件是:0.01 mol/L-5000# > 0.1 mol/L-5000# > 0.01 mol/L-3000# > 0.1 mol/L-3000# > 0.01 mol/L-1200# > 0.1 mol/L-1200# > 0.01 mol/L-400# > 0.1 mol/L-400# > 0.01 mol/L-180# > 0.1 mol/L-180#.随着温度、浓度、粗糙度的升高和进行浸泡处理,Vit1的自腐蚀电流密度亦会会随之增大,其耐腐蚀能力随之下降.Ecorr是在没有外加电流时金属达到一个稳定腐蚀状态时的电位,其大小通常能反应材料的耐腐蚀性[37].只改变温度(图2a和表1),在0.01 mol/L的浓度下,温度升高,Ecorr都有不同程度的升高,曲线正移;在0.1 mol/L的浓度下,只有浸泡后升高温度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.只改变浓度(图2a和表1),在25 ℃条件下,浓度增大,Ecorr都有不同程度的升高,曲线正移;在35 ℃条件下,只有浸泡后增大浓度,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.经过浸泡处理(图2a和表1),只有0.1 mol/L-35 ℃条件下经过浸泡处理,Ecorr下降,曲线负移,其余Ecorr均有不同程度的升高,曲线正移.改变粗糙度(图2b和表1),在0.01 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到5000#时,Ecorr反而下降,曲线负移;在0.1 mol/L条件下,随着粗糙度的下降,Ecorr升高,曲线正移,当粗糙度达到3000#和5000#时,Ecorr下降,曲线负移.经过对比,Ecorr无明显一致性的变化规律,造成这一现象的原因是电化学系统中常常存在噪声,特别是在低电流密度下,这些噪声可能导致腐蚀电位的波动.噪声可能来自仪器、环境干扰或者电极表面微观的电化学现象,这些都会造成腐蚀电位没有明显的规律[38]. ...
Effects of substrate temperature and deposition time on the morphology and corrosion resistance of FeCoCrNiMo0.3 high-entropy alloy coating fabricated by magnetron sputtering
1
2020
... 式中,ZCPE为CPE的阻抗,j为虚数单位,ω为角频率,Q为CPE导纳的模,α为扩散效应指数(0 ≤ α ≤ 1,若α = 1,CPE则为理想电容)[39].拟合得到的参数见表1. ...
Effect of structural state on corrosion properties of all metal Fe based amorphous alloys
1
2022
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
结构状态对全金属Fe基非晶合金腐蚀性能的影响
1
2022
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
Susceptibility of chloride ion concentration, temperature, and surface roughness on pitting corrosion of CoCrFeNi medium-entropy alloy
1
2021
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
Electrochemical corrosion performance of Zr2TiCuNiBe high-entropy metallic glass
1
2023
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
Zr2TiCuNiBe高熵非晶合金的电化学腐蚀行为
1
2023
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
Effects of temperature and chloride ion concentration on electrochemical corrosion of Cr13 tubing in completion fluid
1
2023
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
温度和Cl-浓度对完井液中Cr13油管的电化学腐蚀的影响
1
2023
... 图3a~c是不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的Nyquist图.可以看出,曲线图都呈现出一个宽大的容抗弧,其半径能体现电极表面失去电子的相对难易程度,半径越大,失去电子越难,金属耐腐蚀性能越好[40,41].图3a~c表明无论是改变温度、浓度、粗糙度还是进行浸泡处理,Nyquist图谱都由单一容抗弧组成,说明在升温、增大浓度、改变粗糙度、浸泡处理后Vit1仍具有较好的耐蚀性能,腐蚀机理未发生改变[42].结合图3和表1进行分析.对比升温前后容抗弧大小,可见Rct1 > Rct2,Rct3> Rct4,Rct5> Rct6,Rct7> Rct8,表明温度升高,Vit1耐腐蚀性随之下降;对比升高浓度前后容抗弧大小,Rct1 > Rct3,Rct2 > Rct4,Rct5 > Rct7,Rct6 > Rct8,表明随着浓度升高,耐腐蚀性也降低;对比改变粗糙度后容抗弧大小,Rct13 > Rct12> Rct11> Rct10> Rct9,Rct18 > Rct17> Rct16> Rct15 > Rct14,表明随着粗糙度的增大,Vit1的耐腐蚀性下降;对比未浸泡和浸泡处理的Vit1容抗弧大小,Rct1 > Rct5,Rct2 > Rct6,Rct3> Rct7,Rct4 > Rct8,表明浸泡处理后的Vit1耐腐蚀性能下降.图3d~f是Bode图,在图中低频段代表了材料的耐腐蚀能力,低频段阻抗值越高,说明其耐腐蚀性越好[43].从低频区可以得出在温度、浓度和浸泡处理研究中Vit1的耐腐蚀性能由强到弱对应到实验条件:0.01 mol/L-25 ℃ >0.01 mol/L-35 ℃ >IC 0.01 mol/L-25 ℃ >IC 0.01 mol/L-35 ℃ >0.1 mol/L-25 ℃ >0.1 mol/L-35 ℃ >IC 0.1 mol/L-25 ℃ >IC 0.1 mol/L-35 ℃,粗糙度对耐腐蚀性影响研究中Vit1的耐腐蚀性能由强到弱对应的实验条件是:0.01 mol/L-5000# >0.1 mol/L-5000# >0.01 mol/L-3000# >0.1 mol/L-3000# >0.01 mol/L-1200# >0.1 mol/L-1200# >0.01 mol/L-400# >0.1 mol/L-400# >0.01 mol/L-180# >0.1 mol/L-180#.与极化曲线结果一致.图3g~i是相图,可以看出在温度、浓度和浸泡处理研究中曲线相位角变化不明显,说明各种实验条件下Vit1都保持着较好的耐腐蚀性能,而随着粗糙度的增大,曲线相位角变低,变窄.通过升高温度、浓度和进行浸泡处理,IC 0.1mol/L-35 ℃条件下较0.01 mol/L-25 ℃条件下的相角峰从90°降低到85°,表明升高温度、浓度和进行浸泡处理后,Vit1的耐腐蚀性能下降.在0.01 mol/L条件下,180#相角峰较5000#从87°下降到77°,而在0.1 mol/L条件下,相角峰从85°下降到78°,耐腐蚀性下降,电化学阻抗结论与极化曲线测试结果一致,温度、浓度、粗糙度增大和进行浸泡处理,Vit1的耐腐蚀性能都会下降. ...
Glass forming ability and corrosion behavior of Ti-Zr-Be-Cu-Co bulk metallic glass
1
2013
... 图4为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后表面SEM图.一般认为,合金的耐腐蚀性能与其微观组织结构和表面的性质有密切关系[44].经过肉眼观察,实验后Vit1宏观表面光亮,并没有观察到明显腐蚀痕迹.通过SEM图像观察微观腐蚀形貌,可见在基体上观察到随机分布不规则形状的腐蚀产物.整体上看Vit1在不同温度、浓度、粗糙度和浸泡处理后都表现出良好的耐腐蚀性.实验后虽然其表面保持平整,但是出现了局部腐蚀产物,腐蚀产物附着在合金的表面形成了沉积,并未溶解到溶液中去. ...
Ti-Zr-Be-Cu-Co块体非晶合金形成能力及其耐蚀性的研究
1
2013
... 图4为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后表面SEM图.一般认为,合金的耐腐蚀性能与其微观组织结构和表面的性质有密切关系[44].经过肉眼观察,实验后Vit1宏观表面光亮,并没有观察到明显腐蚀痕迹.通过SEM图像观察微观腐蚀形貌,可见在基体上观察到随机分布不规则形状的腐蚀产物.整体上看Vit1在不同温度、浓度、粗糙度和浸泡处理后都表现出良好的耐腐蚀性.实验后虽然其表面保持平整,但是出现了局部腐蚀产物,腐蚀产物附着在合金的表面形成了沉积,并未溶解到溶液中去. ...
Electrochemical corrosion behaviors before and after laser polishing of additive manufactured TC4 titanium alloy
1
2020
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
增材制造TC4钛合金在激光抛光前后的电化学腐蚀性能
1
2020
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
Corrosion behavior of the bulk amorphous Mg65Cu25Gd10 alloy
1
2009
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
Mg65Cu25Gd10非晶合金的腐蚀行为
1
2009
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
Corrsion behavior of Zr53.5Cu26.5Ni5-Al12Ag3 bulk metallic glass in NaOH
1
2012
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
锆基非晶合金在NaOH溶液中的腐蚀行为
1
2012
... 增大浓度,对比图4a~e和4f~j,图4k~o和4p~t,结果都表明0.1 mol/L-NaOH溶液腐蚀后的Vit1表面腐蚀产物比其在0.01 mol/L-NaOH溶液腐蚀后的腐蚀产物数量多,面积大,说明随着腐蚀液浓度的升高,Vit1的腐蚀程度加剧.升高温度,图4a和b、d和e、f和g、i和j对比可见,35 ℃腐蚀后的Vit1表面腐蚀产物比其在25 ℃下腐蚀后的表面腐蚀产物多且面积大,说明随着腐蚀溶液温度的升高,腐蚀情况加剧,Vit1的耐腐蚀性降低.改变Vit1表面粗糙度,图4k~o和p~t结果表明,随着粗糙度下降,腐蚀产物数量随之减少,但在0.01 mol/L-3000#、0.1 mol/L-3000#和0.1 mol/L-5000#条件中腐蚀产物数量虽然减少,但面积变大.这是因为较为光滑的表面具有较低的局部应力集中[45],腐蚀反应趋于均匀.进行浸泡处理,图4a、b、f、g对比图4d、e、i、j,观察到进行浸泡处理后样品腐蚀形貌变化最大,未浸泡处理的Vit1表面腐蚀产物少、小、分散分布,浸泡处理后的Vit1表面腐蚀产物多、大、密集分布,并且浸泡处理后的Vit1表面出现了更多连在一起形状不规则的腐蚀产物,说明进行浸泡处理后Vit1耐腐蚀性降低.实验结果表明随着温度、浓度、粗糙度的增加和进行浸泡处理,Vit1表面的腐蚀产物增多,腐蚀产物面积增大,Vit1的耐腐蚀能力下降.腐蚀产物的形成可能是因为非晶合金的结构组织在宏观上是各向同性的,没有晶态合金的缺陷,然而非晶合金在制备过程中必然造成微观组织成分和应力分布不均匀,组织分布的不均匀性以短程有序或成分的偏聚形式体现出来[46],所以Vit1生成腐蚀产物的地方首先出现在组分不均匀或者应力集中的地方,腐蚀只要在这些区域发生,就会迅速扩展开来,随后的腐蚀引起合金元素的溶解,溶解的离子可能重新在合金表面形成沉积,生成不溶性粘附的碱盐或偏碱盐,从而加快了腐蚀速度[47]. ...
Quantifying the microstructure and phase assemblage of alkali-activated fly ash/slag materials by EDS mapping analysis
1
2023
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...
Heterogeneity: The soul of metallic glasses
1
2017
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...
不均匀性: 非晶合金的灵魂
1
2017
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...
1
2010
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...
1
2010
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...
Tetragonal phase stability in ZrO2 film formed on zirconium alloys and its effects on corrosion resistance
1
2007
... 通过EDS表征能够深入了解合金材料的成分特征[48],图5为不同表面粗糙度的Vit1样品在不同条件的NaOH溶液浸泡后的EDS分析图.图5a为IC 0.1mol/L-35 ℃实验样品的表面形貌SEM图,其中CP表示明显腐蚀产物区,S表示平整区.图5b是对该样品中CP区和S区进行元素面扫描后得到的化学成分能谱色散图.将CP区和S区对比,可见,Zr在S区中的色散图明显比CP区的颜色清晰,Be在CP区中色散图明显比S区清晰,Ti、Ni、Cu在S区的色散图颜色比CP区中较清晰,表明S区中Zr含量明显高于CP区,CP区中Be含量明显高于S区,而S区中Ti、Ni、Cu虽高于CP区,但并无Zr、Be对比明显.图5c~f为改变温度、浓度和粗糙度,浸泡处理,电化学腐蚀后CP区和S区中化学成分的单位原子百分比,结合所有条件下的数据对比可见,CP区中主要是Be,单位原子百分比达到了90%~97%,而S区中Be单位原子百分比相对较小.在S区中主要是Zr,而CP区中Zr单位原子百分比相对较小.Ti、Ni、Cu在S区中的单位原子百分比相对高于他们在CP区中的.平整区和腐蚀产物区中元素含量上的差异可能是由于Vit1中元素含量的不均匀,元素间混合焓和成键的差异,元素之间的邻域关系反映了不同的偏好,使元素浓度的局部分布呈现不均匀性[49].在电化学腐蚀过程中,各元素的电极电位不同,而Be的电极电位比较低,会优先发生电极反应并析出形成腐蚀产物[50],因而Vit1的腐蚀产物中主要是Be.Zr具有较强的亲氧性,易形成稳定的氧化物[51],附着在基底表面.腐蚀产物更倾向于富集Be,形成Be(OH)2,这是由于铍的氧化反应较为容易,且通常具有较低的溶解度,能够较为稳定地存在于腐蚀产物中. ...