高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] 。据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] 。大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] 。空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] 。沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液。盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀。本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系。
1 实验方法
研究环境对金属大气腐蚀的影响效果,当环境中多种因素间存在交互作用时,需要明确不同影响因素对腐蚀的作用能力。针对温度 (T )、相对湿度 (RH) 与盐沉积量 (C dep ) 对Cu腐蚀的影响,设置3因素2水平的恒定条件,控制变量研究不同因素的作用规律。为了模拟湿热海洋气候下的金属大气腐蚀,对试验片表面沉积定量NaCl,在温湿箱内控制环境温度及相对温湿度,利用NaCl的潮解效应在试验片表面获得具有一定浓度、厚度、分布均匀且易于控制的液膜。设置不同环境因素的试验条件,参照表1 组合不同条件进行试验;试验过程中各环境条件保持不变,每组试验时长30 d以上,定期回收试验片并进行测重与腐蚀失重分析。
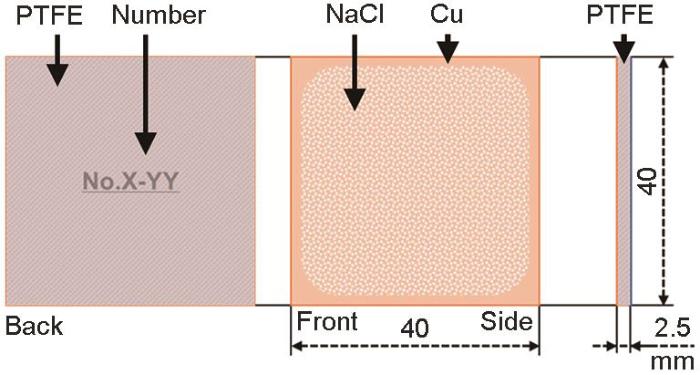
选用纯度4N金属Cu加工成40 mm×40 mm×2.5 mm的形状作为试验片使用 (见图1 ),使用碳化硅砂纸对于试验片表面进行湿式研磨 (400→800#)至无明显划痕,之后分别使用去离子水、无水乙醇、丙酮清洗试验片表面并冷风干燥,干燥状态下 (室温,RH˂30%) 对各试验片称重并做记录。正交试验前针对试验片进行封装处理,限定试验片的一侧表面为有效反应面 (既正表面),使用聚四氟乙烯 (PTFE)胶带紧密贴合试验片侧面及背面。调制浓度为0.1 kmol·m-3 的NaCl溶液,分别定量沉积NaCl溶液273和54.6 μL于试验片表面;为了使液滴铺展覆盖样片表面80%以上的面积,同时滴下1~5 mL乙醇,随后将试验片保存于干燥箱内 (60 °C,10 min) 使表面溶液迅速挥发,制得表面NaCl沉积量为1.0和0.2 g·m-2 的试验片。
图1
图1
正交试验样品模式图
Fig.1
Schematic drawing of experimental sample
腐蚀正交试验后取出试验片并参照GB/T 19292.4-2018 [9 ] 清洗除锈并称重、计算失重量。除锈步骤:去除PTFE胶带及表面松散的腐蚀产物,使用氨基磺酸50 g加蒸馏水制成1000 mL除锈剂,保持溶液温度在20~25 °C,将试验片浸泡清洗10~15 min,随后使用去离子水、无水乙醇、丙酮清洗试验片表面并冷风干燥。除锈后对各试验片称重并做记录,腐蚀失重量 (w , g·m-2 ) 与腐蚀失重速率 (v , g·m-2 ·s-1 ) 计算公式如下所示:
w = ( m 0 - m 1 ) / A (1)
v = m 0 - m 1 A ⋅ t (2)
其中,m 0 和m 1 为腐蚀前和去除表面腐蚀产物后试验片质量 (g),A 为初始有效反应面积 (m2 ),t 为试验时长 (s)。
2 实验结果
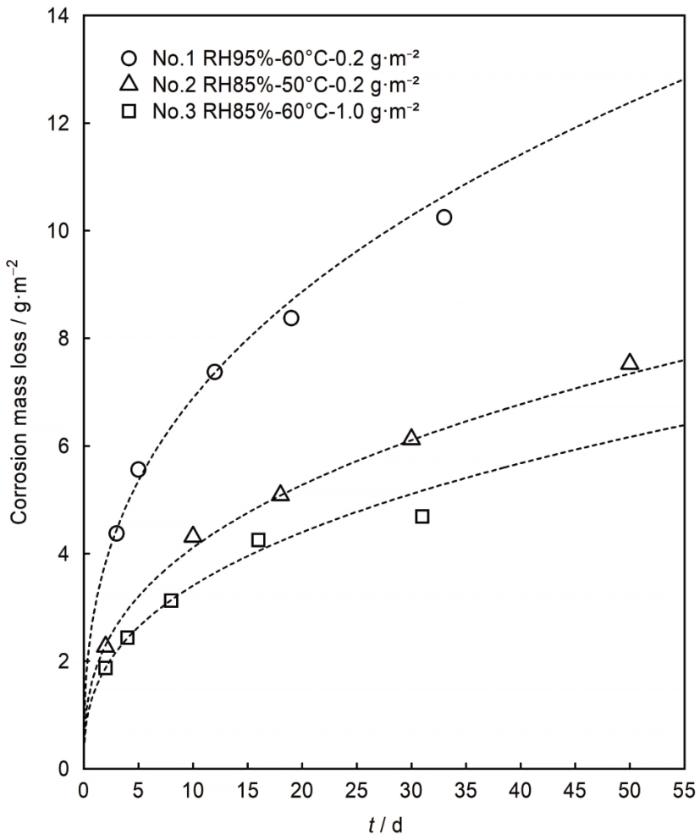
根据腐蚀正交试验Cu腐蚀失重变化的测量结果,对比不同试验时长试验片腐蚀失重量变化绘制图2 ,对比不同试验时长试验片腐蚀失重速率的变化绘制图3 。根据图2 通过对比No.1、No.2实验结果可知,盐沉积量一定条件下,随温度、相对湿度上升腐蚀失重量显著增加;对比No.2、No.3实验结果可知,相对湿度一定条件下,随温度、盐沉积量上升导致腐蚀失重量降低;对比No.1、No.3实验结果可知,固定温度、提高相对湿度、同时降低盐沉积量,结果导致腐蚀失重量大幅度增加。由此根据不同稳态条件下纯Cu的腐蚀量的差异性变化可知,本试验条件范围内,相对湿度的增加对腐蚀量有较大的增益影响,而温度及盐沉积量的增加对Cu腐蚀量带来的提升效果并不明显亦或导致腐蚀量降低。
图 2
图 2
不同环境条件下金属失重量与时间变化
Fig.2
Mass losses of Cu as a function of time under different environmental conditions
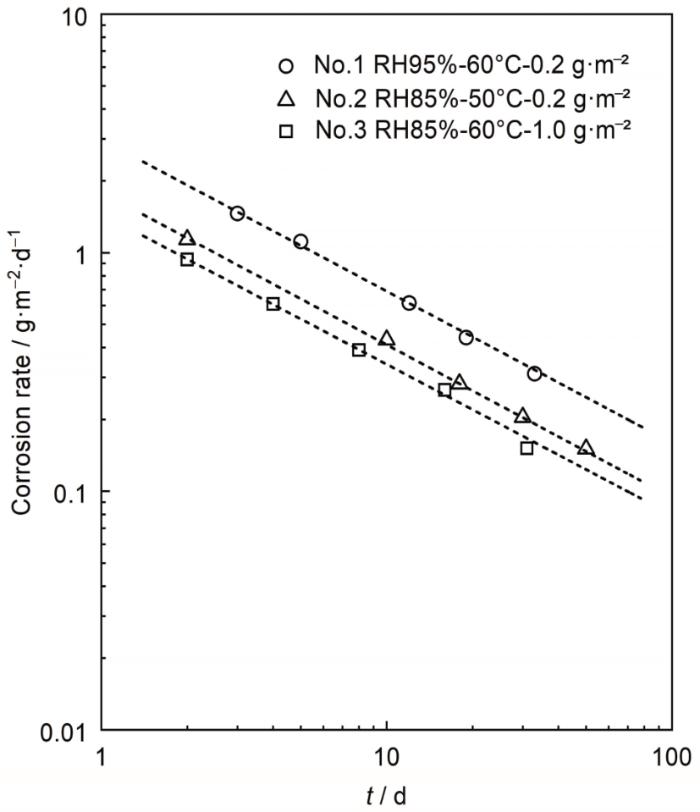
图3
图3
腐蚀速率与时间变化关系
Fig.3
Corrosion rates of Cu as a function of time under different environmental conditions
图3 结果显示Cu的腐蚀速率随时间变化呈递减趋势。ISO 9224-2012 [10 ] 对材料在大气环境中的腐蚀速率的预测展开了论述,金属及其合金在大气中的腐蚀速率会随着暴露时间变化,由于表面腐蚀产物的积累,大多数金属及其合金的腐蚀速率会随暴露时间的延长而降低。据研究表明[10 ] 累积腐蚀量D 与暴露时间t 通常存在以下关系:
D = r c o r r ⋅ t b (3)
d D d t = b r c o r r t b - 1 (4)
其中,r c o r r b 为时间指数 (通常小于1),由金属种类与环境类型决定。根据图3 所示腐蚀正交试验金属失重变化实验结果可以看出,对于不同环境因素下各腐蚀失重随时间变化趋近于幂函数关系,3种条件的时间指数拟合结果相近b ≈0.35,表明各试验环境严酷度相近。
3 讨论
3.1 沉积盐对大气腐蚀的影响
当金属材料所处环境大气含有盐雾时,伴随海盐粒子沉积于金属表面,受环境温湿度变化影响沉积盐潮解生成电解质液膜,引发电化学腐蚀。金属大气腐蚀阴极过程的还原反应速率与O2 (反应物) 在电解质液膜中的溶解度和扩散有关,研究环境对大气腐蚀液膜特性及金属腐蚀过程的影响,建立环境因素对液膜盐浓度、溶解氧浓度、溶解氧扩散速率等与腐蚀直接相关要素的量效关系。
基于NaCl (盐雾) 的物理特性,NaCl在一定相对湿度下发生潮解,环境的温度越高盐发生潮解的临界湿度则越低;NaCl的临界潮解湿度 (RHsat , %) 与温度 (T ,°C) 的关系满足以下公式[11 ] :
R H s a t = ( - 3.27 × 10 - 4 T + 0.7605 ) × 100 % (5)
NaCl潮解生成的盐溶液在平衡状态下,溶液浓度/盐度在温度一定条件下随相对湿度升高而降低。NaCl溶液的平衡浓度 (C NaCl ,kmol·m-3 ) 与温度 (T ,°C) 及相对湿度 (RH, %) 的关系满足以下公式[11 ] :
C N a C l = 2.378 × 10 - 2 T ⋅ R H - 22.37 R H -
2.378 × 10 - 2 T + 22.37 (6)
式中,RH适用区间为[RHsat ,100%)。根据文献NaCl溶液密度 (ρ , kg·m-3 ) 与溶液盐度(S , %)和温度(T , °C)满足以下关系[12 ] :
ρ = 1006 + 737.7 S - 0.311 T - 1.993 × 10 - 3 T 2 (7)
该公式适用于温度范围0~100 °C、盐度1%~26% (质量分数) 之间的NaCl溶液。其中,盐度 (S , mass %) 与溶液密度 (ρ , kg·m-3 ) 及溶液浓度 (C NaCl , kmol·m-3 ) 的关系有:
S = C N a C l ⋅ M N a C l ρ × 100 % (8)
式中,M N a C l -1 )。盐沉积量 (C dep , g·m-2 ) 已知情况下,NaCl潮解形成的单位面积溶液体积 (V , dm3 ·m-2 )有:
V = C d e p ρ ⋅ S = C d e p C N a C l ⋅ M N a C l (9)
代入上述潮解盐溶液浓度C NaCl 可对上式进行求解,当潮解溶液的铺展效果可被忽略情况下,平均液膜厚度 (L , mm) 等于单位面积的溶液体积 (V , dm3 ·m-2 )。
关于氧在溶液内的溶解度,在一定温度和压强下气体在单位体积液体溶剂中可被溶解的最大量被称为该气体在溶液内的溶解度。氧在水中的溶解度遵守亨利定律,气体溶质在液体中的溶解度与所处温度及压力条件下液面上的气体 (溶质) 分压成正比,既有:
P g = α ⋅ C g (10)
其中,P g 是气相与液相在平衡状态时的气体分压,α 是Bunsen系数 (常数),C g 是气体在水中的浓度。而对于NaCl溶液,受盐析效应[13 ] 影响,氧的溶解度会随体系含盐量增大而降低。不同温度及盐度溶液内的氧溶解度可使用Weiss方程进行精确计算[14 ] 。在一定盐度、温度条件下,气体浓度由Van't Hoff方程的积分形式获得,溶液中氧的溶解度 (C O 2 ' 3 ·L-1 ) 与环境温度 (T , °C) 及溶液盐度 (S , ‰) 的关系如下[14 ] :
l n C O 2 ' = A 1 + A 2 ( 10 2 × T - 1 ) + A 3 l n ( T × 10 - 2 ) +
A 4 ( T × 10 - 2 ) + S ( B 1 + B 2 T × 10 - 2 + B 3 T 2 × 10 - 4 ) (11)
式中 ,A 1 =-173.4292 , A 2 =249.6339 , A 3 =143.3843 , A 4 =-21.88492 , B 1 =-0.033096 , B 2 =0.014259 , B 3 =-0.001700 。 氧溶解度 (C O 2 -3 ) 单位换算:
C O 2 = P × C O 2 ' R × ( T + 273.15 ) (12)
其中,P 为大气压力 (101325 Pa),R 为气体常数,T 为温度 (°C)。
在金属Cu的大气腐蚀正交试验过程中,各环境因素条件保持一定。通过上述计算可获得试验期间相应环境条件下产生的NaCl液膜的各物理性能,如表2 所示。
3.2 电解质液膜内氧的扩散
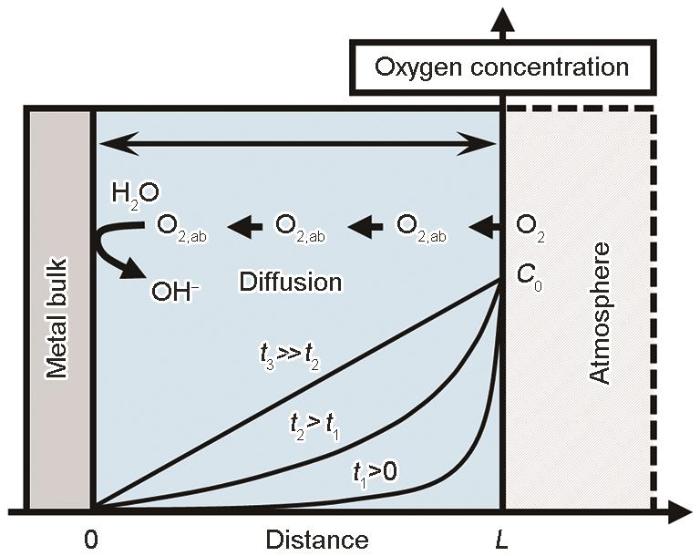
金属大气腐蚀起因于电解液薄膜下形成微电池所引发的电化学腐蚀,过程通常以O2 作为阴极去极化剂使金属发生腐蚀。O2 从空气中经由电解质液膜扩散到金属界面参与反应并被消耗,在电解质液膜内O2 的扩散模式如图4 所示。一般大气条件下,金属表面上形成的中性液膜内氧的还原反应如下式所示:
2 H 2 O + O 2 + 4 e - → 4 O H - (13)
图4
图4
电解质液膜中氧的溶解与扩散变化及反应示意图
Fig.4
Schematic diagram of dissolution, diffusion and reaction of oxygen in electrolyte solution
伴随金属腐蚀反应进行,金属表面附近溶液内的溶解氧被消耗、浓度降低,此时O2 通过扩散转移到金属表面并在金属表面附近一定范围内形成浓度差。图4 展示了电解液膜形成初期溶液内氧的浓度分布随时间的变化。在薄液膜内液体流速为零,O2 由大气向液膜内扩散,当系统处于定常状态 (图4 ,t 3 ) 时,液膜内部金属界面附近溶解氧O2,ab 浓度与离金属距离呈线性变化。液膜内的O2,ab 浓度与O2,ab 扩散速率受周围环境影响,其变化直接改变金属大气腐蚀速率。
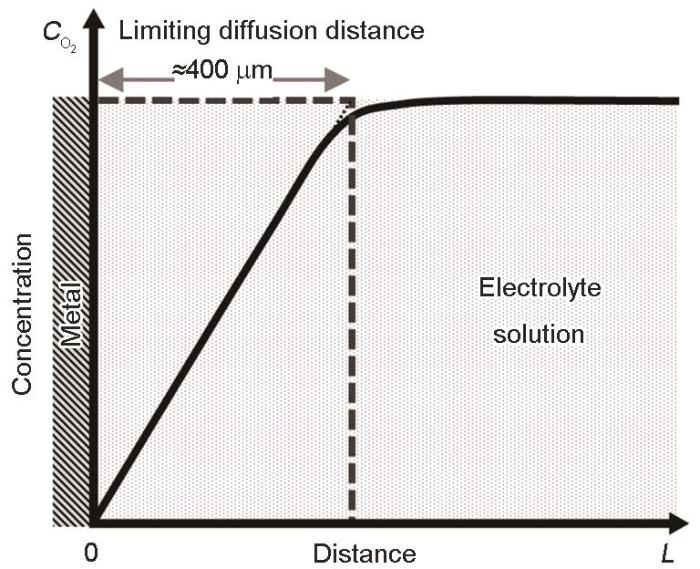
电解质溶液内的O2 在金属表面发生还原反应被消耗,当阴极还原反应速度>氧扩散速度时,还原速度受氧的扩散速度控制,金属界面处O2 浓度为零。根据Fick定律,在单位时间内通过垂直于扩散方向的单位截面积的扩散物质流量与该截面处的浓度梯度成正比。如图5 所示,溶液内气体扩散并出现浓度梯度的现象局限于金属表面一定距离范围内,既存在极限扩散距离 (Nernst扩散层)。研究表明[15 ] ,对于静止水溶液内氧的极限扩散距离约400 μm。垂直于金属表面方向的一维扩散流束 (J , mol·m-2 ·s-1 ) 可根据Fick第一定律表达为下式:
J = - D d C d L (14)
式中,D 为氧气的扩散系数,dC /dL 为稳态条件下金属近表面的氧的浓度梯度。对此,当液膜厚度小于扩散层厚度,即L ≤400 μm时,氧扩散速率为:
J O 2 = - D C O 2 / L (15)
当液膜厚度大于扩散层厚度,即L >400 μm时,氧扩散速率为:
J O 2 = - D C O 2 / 0.4 [ m m ] (16)
式中,C O 2 -3 )。NaCl溶液中O2 的扩散系数 (D , m2 ·s-1 ) 符合下式[11 ] :
D = ( - 1.464 × 10 - 4 C N a C l + 2.051 ) × 10 - 9 (17)
其中,C NaCl 为NaCl溶液的浓度(kmol·m-3 )。
图5
图5
浓度随扩散距离的变化
Fig.5
Concentration distribution of oxygen in electrolyte solution
由于大气环境材料表面自然形成的液膜体积有限,伴随腐蚀液膜内的O2 被持续消耗,当溶液内氧的平衡蒸汽压小于空气中氧的分压,既溶解氧浓度低于溶解度时,O2 将由大气自发传递到液膜内。氧的溶解过程是O2 自气相到液相的转移过程,根据双膜理论[16 ] ,O2 的传递速度R O 2
R O 2 = K L α ( C O 2 - C 0 ) (18)
式中,C 0 C O 2 KLα 为O2 传递系数。其中,传递系数KLα 的影响因素有:
K L α = f ( D , μ , ρ , g , T , R e ⋯ ) (19)
式中,D 为扩散系数,μ 为溶液粘度,ρ 为溶液密度,g 为重力加速度,T 为温度,Re为Reynolds系数。对于NaCl溶液,氧的溶解速率 (R O 2 -2 ·s-1 ) 可用下式表达[17 ] :
R O 2 = α × 10 - β ⋅ C N a C l × e x p ( - γ ⋅ T ) (20)
式中,α= 1.77×10-5 , β =0.05, γ =0.01335, C NaCl 为NaCl溶液的浓度 (kmol·m-3 ),T 为温度 (°C)。
3.3 腐蚀速率计算
金属大气腐蚀阴极过程反应所需的氧需要由大气/电解质层界面溶解进入液体并扩散至金属表面才能参与反应,Frankel等[18 ] 预测极限扩散电流密度I lim 与液膜厚度呈反比的关系。根据Farday定律,即为在电极界面上发生化学变化物质的质量与通入的电量成正比:
I = n F ξ (21)
结合Fick定律可对极限扩散电流密度 (I lim , A·m-2 )与氧的溶解/扩散速度的关系进行推导:
I l i m = n c F ξ = n c F J O 2 ( R O 2 > J O 2 ) n c F R O 2 ( J O 2 > R O 2 ) (22)
其中,F 为Faraday常数 (96485 C·mol-1 ),根据氧的阴极反应n c =4。腐蚀过程中金属/溶液界面处电子导体相 (金属) 与离子导体相 (电解质溶液) 相接触,两相之间发生电荷转移。伴随阳极反应金属发生溶解,阳极反应表现为:
C u ( M ) = C u ( s o l ) + + e - (23)
对于受氧溶解/扩散控制的腐蚀过程,根据电子守恒可由阴极反应扩散电流密度I lim 计算一定时间内的金属阳极反应速率;此时Cu的大气腐蚀速率 (ν Cu , g·m-2 ·s-1 ) 可通过以下公式进行表达:
ν C u = I l i m M C u n a F (24)
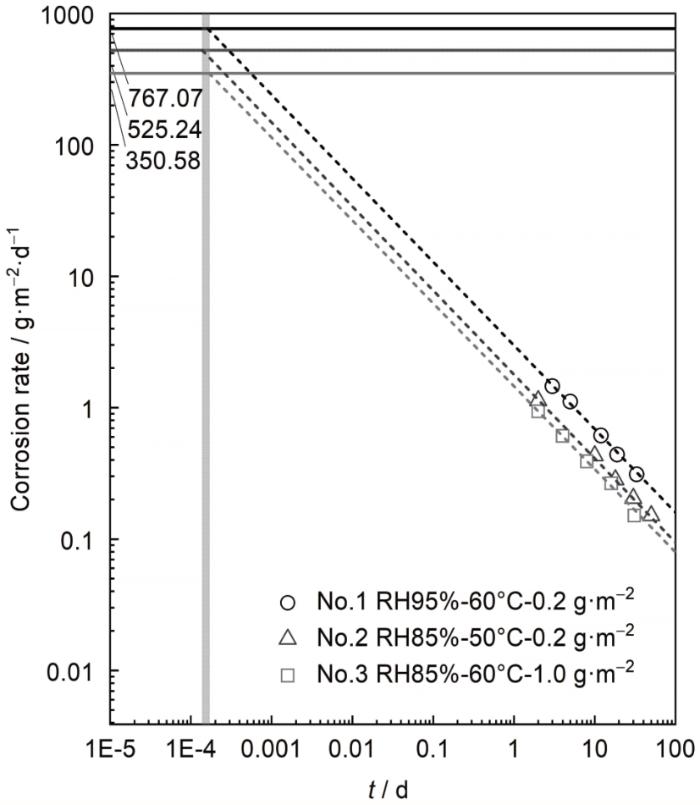
其中,M Cu 为Cu的摩尔质量 (63.5 g·mol-1 ),根据Cu的阳极反应n a =1。根据Cu的正交试验条件计算获取腐蚀反应的环境影响状态参数 (如表2 所示),No.1~3三种不同条件下,Cu的大气腐蚀速率分别为767.07、525.24和350.58 g·m-2 ·s-1 。对比正交实验测试结果,如图6 所示,根据腐蚀失重速率的时间变化趋势推导得到,对于不同环境条件腐蚀失重速率在t =12 s时与计算值一致。
图6
图6
不同条件下暴露不同时间后Cu腐蚀速率的理论计算值与实测值
Fig.6
Calculated and measured data of corrosion rate of Cu after exposure for different time under different conditions
当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制。试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显。另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间。在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果。Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] 。Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大。由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异。在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动。腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律。
4 结论
(1) 针对NaCl潮解特性的分析,提出了利用NaCl的潮解效应,实现在试验片表面获得有一定厚度、浓度的盐液膜从而模拟大气腐蚀,这与实际湿热环境大气腐蚀的相似度较高。
(2) 采用正交实验对比分析法,明确了温湿度与盐沉积量对含盐Cu片腐蚀的影响效果,其中相对湿度的增加对腐蚀量有较大的正面影响,而盐的大量沉积对金属腐蚀带来的提升效果并不明显亦或导致腐蚀量降低。
(3) 试验结果显示Cu的腐蚀失重速率随腐蚀时间的增加而连续降低,Cu表面生成保护性氧化膜。
(4) 针对电解质溶液中氧的溶解/扩散速度进行了相关性分析,并对阴极控制的初期金属腐蚀速率度进行预测。根据试验环境条件通过极限扩散电流密度计算得到的腐蚀速率大于试验测量值,大小关系与实际腐蚀测量值一致,计算过程中需考虑实际反应速率控制步骤,同时需进一步考察腐蚀产物的影响效果。
参考文献
View Option
[1]
Soares C G Garbatov Y Zayed A et al . Influence of environmental factors on corrosion of ship structures in marine atmosphere
[J]. Corros. Sci. , 2009 , 51 : 2014
DOI
URL
[本文引用: 1]
[2]
Wan Y Song F L Li L J Corrosion characteristics of carbon steel in simulated marine atmospheres
[J]. J. Chin. Soc. Corros. Prot. , 2022 , 42 : 851
万 晔 , 宋芳龄 , 李立军 基于海洋大气环境因素影响下的碳钢腐蚀特征研究
[J]. 中国腐蚀与防护学报 , 2022 , 42 : 851
[3]
Rice D W Peterson P Rigby E B et al . Atmospheric corrosion of copper and silver
[J]. J. Electrochem. Soc. , 1981 , 128 : 275
DOI
[本文引用: 1]
[4]
Biezma M V San Cristóbal J R Methodology to study cost of corrosion
[J]. Corros. Eng. Sci. Technol. , 2005 , 40 : 344
DOI
URL
[本文引用: 1]
[5]
Cui Z Y Ge F Wang X Corrosion mechanism of materials in three typical harsh marine atmospheric environments
[J]. J. Chin. Soc. Corros. Prot. , 2022 , 42 : 403
[本文引用: 1]
崔中雨 , 葛 峰 , 王 昕 几种苛刻海洋大气环境下的海工材料腐蚀机制
[J]. 中国腐蚀与防护学报 , 2022 , 42 : 403
DOI
[本文引用: 1]
以南极低温高辐照冰雪凝-融环境、南海高温高湿高盐雾环境以及滨海氯-霾耦合环境3种典型环境为研究对象,开展了典型海工材料的腐蚀行为研究。结果表明,南极低温环境下冰层、雪层覆盖下电化学腐蚀过程依然可以发生,冰雪凝-融过程导致液膜长周期存在促进了腐蚀的进行且加速局部腐蚀。南海高温高湿高盐雾环境下有色金属材料表面存在化学氧化和电化学腐蚀协同作用机制,不同铝合金的局部腐蚀萌生扩展驱动力不同 (即扩散与电荷转移、氢致沿晶裂纹、腐蚀产物楔入效应),表面润湿时间和Cl<sup>-</sup>协同作用导致腐蚀动力学偏离幂函数规律。滨海氯-霾耦合环境下NH<sub>4</sub><sup>+</sup>加速腐蚀的关键控制因素为缓冲效应导致的持续供H<sup>+</sup>,Cl<sup>-</sup>、NH<sub>4</sub><sup>+</sup>、NO<sub>3</sub><sup>-</sup>协同作用下镁合金发生“类自催化点蚀”。
[6]
Christofer L Thomas E G Atmospheric Corrosion [M]. Beijing : Chemical Industry Press , 1996
[本文引用: 1]
[7]
Ma X Z Meng L D Cao X K et al . Influence of Co-deposition of pollutant particulates ammonium sulfate and sodium chloride on atmospheric corrosion of copper of printed circuit board
[J]. J. Chin. Soc. Corros. Prot. , 2022 , 42 : 540
[本文引用: 1]
马小泽 , 孟令东 , 曹祥康 等 . 大气污染物硫酸铵和氯化钠混合盐粒沉降对电路板铜大气腐蚀的加速机制
[J]. 中国腐蚀与防护学报 , 2022 , 42 : 540
DOI
[本文引用: 1]
采用电化学阻抗 (EIS)、石英晶体微天平 (QCM) 和铜箔电阻探针 (TER) 等多种大气腐蚀测量技术,以表面沉积不同比例 (NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub>和NaCl混合盐粒下的电路板铜箔为样本,在气候试验箱中模拟研究了电路板铜在模拟污染大气环境下的初期大气腐蚀行为。结果表明:在30 ℃ RH90%环境中且表面沉积量相同时,在腐蚀初期 (<30 h),(NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub>和NaCl混合盐粒对铜的腐蚀性比沉积单一NaCl盐粒的体系更强;但30 h后,情况发生反转,混合盐粒对铜的腐蚀相比单一NaCl盐粒体系反而显著降低,且当混合比例为1∶1时,(NH<sub>4</sub>)<sub>2</sub>SO<sub>4</sub>对NaCl腐蚀的抑制作用最强 (抑制比达84%)。通过腐蚀产物的SEM、XRD、XPS分析可知,在腐蚀前期,由于NH<sub>4</sub><sup>+</sup>对Cu的腐蚀促进作用使铜表面快速形成了较为致密的Cu<sub>2</sub>O腐蚀产物,从而显著减缓了铜基底腐蚀。尽管沉积NaCl盐粒的铜表面也生成了Cu<sub>2</sub>O腐蚀产物,但相对比较疏松多孔,反而会因为腐蚀产物的阴极促进作用加速腐蚀产物层下的Cu腐蚀。
[8]
Wang X Chen J H Wang W Review of study in hygroscopic properties of aerosol particles
[J]. China Powder Sci. Technol. , 2010 , 16 (1 ): 101
[本文引用: 1]
王 轩 , 陈建华 , 王 玮 气溶胶吸湿特性研究现状
[J]. 中国粉体技术 , 2010 , 16 (1 ): 101
[本文引用: 1]
[9]
State Administration for Market Regulation , Standardization Administration of the People's Republic of China GB/T 19292.4-2018 Corrosion of metals and alloys—Corrosivity of atmospheres—Part 4: Determination of corrosion rate of standard specimens for the evaluation of corrosivity [S]. Beijing : Standards Press of China , 2018
[本文引用: 1]
国家市场监督管理总局 , 中国国家标准化管理委员会 GB/T 19292.4-2018 金属和合金的腐蚀 大气腐蚀性 第4部分: 用于评估腐蚀性的标准试样的腐蚀速率的测定 [S]. 北京 : 中国标准出版社 , 2018
[本文引用: 1]
[10]
ISO 9224-2012 Corrosion of metals and alloys—Corrosivity of atmospheres—Guiding values for the corrosivity categories [S]. Geneva : ISO copyright office , 2012
[本文引用: 2]
[11]
China National Electric Apparatus Research Institute Co., Ltd Prediction algorithm of metal atmospheric corrosion rate based on transmission dynamics model
[P]. Chin Pat, 2020114294241 , 2022
[本文引用: 3]
中国电器科学研究院股份有限公司 基于物质传递动力学模型的金属大气腐蚀速率预测算法
[P]. 中国专利, 2020114294241 , 2022
[本文引用: 3]
[12]
Xi H Equation for calculating physical properties of sodium chloride solutions
[J]. J. Tianjin Univ. Light Ind. , 1997 , (2 ): 74
[本文引用: 1]
席 华 氯化钠溶液物性关系式
[J]. 天津轻工业学院学报 , 1997 , (2 ): 74
[本文引用: 1]
[13]
Cui X M Wu Z M Discrimination on concept of salt effect
[J]. J. Salt Lake Res. , 2013 , 21 (2 ): 62
[本文引用: 1]
崔香梅 , 乌志明 盐效应概念辨析
[J]. 盐湖研究 , 2013 , 21 (2 ): 62
[本文引用: 1]
[14]
Ma C F Tian R The oxygen saturability of sea water and Weiss equation
[J]. J. Ocean Technol. , 2002 , 21 (1 ): 22
[本文引用: 2]
马传芳 , 田 锐 海水的氧饱和度与韦斯方程
[J]. 海洋技术 , 2002 , 21 (1 ): 22
[本文引用: 2]
[15]
Shinzo O Shiro Y Fumio H et al . Interaction between diffusion process and electrode reaction process under convection conditions
[J]. Electrochemistry , 1957 , 25 : 562
[本文引用: 1]
[16]
Zhang J W Study on the oxygen budgets of grass carp ponds and its critical impact factors
[D]. Shanghai : Shanghai Ocean University , 2012
[本文引用: 1]
张敬旺 草鱼养殖池塘溶氧收支平衡及关键影响因子的研究
[D]. 上海 : 上海海洋大学 , 2012
[本文引用: 1]
[17]
Nippon Steel Corp Metal corrosion rate prediction method and metal corrosion life prediction system
[P]. Jap. Pat., JP2012083140A , 2012
[本文引用: 1]
[18]
Frankel G S Stratmann M Rohwerder M et al . Potential control under thin aqueous layers using a Kelvin Probe
[J]. Corros. Sci. , 2007 , 49 : 2021
DOI
URL
[本文引用: 1]
[19]
Huang H L Dong Z H Chen Z Y et al . The effects of Cl– ion concentration and relative humidity on atmospheric corrosion behaviour of PCB-Cu under adsorbed thin electrolyte layer
[J]. Corros. Sci. , 2011 , 53 : 1230
DOI
URL
[本文引用: 1]
[20]
Deng P C Zhong J Wang K et al . Important influential factor for corrosion of high-altitude marine engineering equipment in atmosphere-chloride ion deposition rate
[J]. J. Chin. Soc. Corros. Prot. , 2020 , 40 : 474
[本文引用: 1]
邓培昌 , 钟 杰 , 王 坤 等 . 海洋工程装备高空腐蚀重要影响因素Cl- 沉降速率研究
[J]. 中国腐蚀与防护学报 , 2020 , 40 : 474
DOI
[本文引用: 1]
采用“风筝悬挂湿烛”大气Cl<sup>-</sup>沉降速率样品收集方法,利用离子色谱法分析样品溶液Cl<sup>-</sup>的浓度,获得了夏季不同月份、不同垂直高度近海大气中Cl<sup>-</sup>沉降速率,利用Pearson相关系数法分析了环境因素对Cl<sup>-</sup>沉降速率的影响。结果表明:南海岛屿夏季三个月大气Cl<sup>-</sup>沉降速率在10~100 m范围内的垂向分布呈反“S”分布;南海岛屿夏季高空大气Cl<sup>-</sup>沉降速率从6月到8月逐渐降低。
[21]
Vera R Delgado D Rosales B M Effect of atmospheric pollutants on the corrosion of high power electrical conductors-Part 2. Pure copper
[J]. Corros. Sci. , 2007 , 49 : 2329
DOI
URL
[本文引用: 1]
[22]
Vera R Delgado D Rosales B M Effect of unusually elevated SO2 atmospheric content on the corrosion of high power electrical conductors-Part 3. Pure copper
[J]. Corros. Sci. , 2008 , 50 : 1080
DOI
URL
[本文引用: 1]
Influence of environmental factors on corrosion of ship structures in marine atmosphere
1
2009
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
Corrosion characteristics of carbon steel in simulated marine atmospheres
0
2022
基于海洋大气环境因素影响下的碳钢腐蚀特征研究
0
2022
Atmospheric corrosion of copper and silver
1
1981
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
Methodology to study cost of corrosion
1
2005
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
Corrosion mechanism of materials in three typical harsh marine atmospheric environments
1
2022
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
几种苛刻海洋大气环境下的海工材料腐蚀机制
1
2022
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
1
1996
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
Influence of Co-deposition of pollutant particulates ammonium sulfate and sodium chloride on atmospheric corrosion of copper of printed circuit board
1
2022
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
大气污染物硫酸铵和氯化钠混合盐粒沉降对电路板铜大气腐蚀的加速机制
1
2022
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
Review of study in hygroscopic properties of aerosol particles
1
2010
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
气溶胶吸湿特性研究现状
1
2010
... 高湿大气环境下,金属表面由于物理吸附或化学凝聚作用等原因形成一层薄液膜 (数微米),薄液膜具有较强的氧扩散性,并且能够溶解空气中的可溶性污染物介质,形成具有腐蚀性的电解液薄膜诱发金属腐蚀[1 ~3 ] .据统计表明,每年因金属材料大气腐蚀造成的经济损失占总腐蚀损失的一半以上[4 ,5 ] .大气腐蚀受温湿度、腐蚀性气体/固体污染物等环境因素影响,其过程涉及气相、液相和固相界面间复杂的物理化学作用[6 ] .空气中不同污染物介质能够改变液膜化学性质,在温湿度共同作用下液膜厚度、电解质浓度、pH及液膜内反应活性物质的扩散速度等会发生改变,直接影响腐蚀反应过程[7 ] .沿海城市空气盐雾浓度高,盐沉积在金属表面吸湿潮解形成电解质溶液.盐的吸湿性强弱与体系化学组分密切相关[8 ] ,而环境温湿度与盐沉积量决定了潮解液膜的浓度、密度和厚度等状态;伴随昼夜干湿循环液膜中的Cl- 会在特定条件下达到较高的浓度,加剧腐蚀.本文以Cu为对象研究金属材料在不同环境条件下的大气腐蚀,针对主要环境因素:温度、相对湿度、沉积盐,进行多因素多变量的正交试验,观察不同条件下金属表面液膜的性状及金属腐蚀行为特征,探明多因素耦合作用现象机理、分析因素间的相互影响规律,建立环境与大气腐蚀之间的量效关系. ...
1
2018
... 腐蚀正交试验后取出试验片并参照GB/T 19292.4-2018 [9 ] 清洗除锈并称重、计算失重量.除锈步骤:去除PTFE胶带及表面松散的腐蚀产物,使用氨基磺酸50 g加蒸馏水制成1000 mL除锈剂,保持溶液温度在20~25 °C,将试验片浸泡清洗10~15 min,随后使用去离子水、无水乙醇、丙酮清洗试验片表面并冷风干燥.除锈后对各试验片称重并做记录,腐蚀失重量 (w , g·m-2 ) 与腐蚀失重速率 (v , g·m-2 ·s-1 ) 计算公式如下所示: ...
1
2018
... 腐蚀正交试验后取出试验片并参照GB/T 19292.4-2018 [9 ] 清洗除锈并称重、计算失重量.除锈步骤:去除PTFE胶带及表面松散的腐蚀产物,使用氨基磺酸50 g加蒸馏水制成1000 mL除锈剂,保持溶液温度在20~25 °C,将试验片浸泡清洗10~15 min,随后使用去离子水、无水乙醇、丙酮清洗试验片表面并冷风干燥.除锈后对各试验片称重并做记录,腐蚀失重量 (w , g·m-2 ) 与腐蚀失重速率 (v , g·m-2 ·s-1 ) 计算公式如下所示: ...
2
2012
... 图3 结果显示Cu的腐蚀速率随时间变化呈递减趋势.ISO 9224-2012 [10 ] 对材料在大气环境中的腐蚀速率的预测展开了论述,金属及其合金在大气中的腐蚀速率会随着暴露时间变化,由于表面腐蚀产物的积累,大多数金属及其合金的腐蚀速率会随暴露时间的延长而降低.据研究表明[10 ] 累积腐蚀量D 与暴露时间t 通常存在以下关系: ...
... [10 ]累积腐蚀量D 与暴露时间t 通常存在以下关系: ...
Prediction algorithm of metal atmospheric corrosion rate based on transmission dynamics model
3
2022
... 基于NaCl (盐雾) 的物理特性,NaCl在一定相对湿度下发生潮解,环境的温度越高盐发生潮解的临界湿度则越低;NaCl的临界潮解湿度 (RHsat , %) 与温度 (T ,°C) 的关系满足以下公式[11 ] : ...
... NaCl潮解生成的盐溶液在平衡状态下,溶液浓度/盐度在温度一定条件下随相对湿度升高而降低.NaCl溶液的平衡浓度 (C NaCl ,kmol·m-3 ) 与温度 (T ,°C) 及相对湿度 (RH, %) 的关系满足以下公式[11 ] : ...
... 式中,C O 2 -3 ).NaCl溶液中O2 的扩散系数 (D , m2 ·s-1 ) 符合下式[11 ] : ...
基于物质传递动力学模型的金属大气腐蚀速率预测算法
3
2022
... 基于NaCl (盐雾) 的物理特性,NaCl在一定相对湿度下发生潮解,环境的温度越高盐发生潮解的临界湿度则越低;NaCl的临界潮解湿度 (RHsat , %) 与温度 (T ,°C) 的关系满足以下公式[11 ] : ...
... NaCl潮解生成的盐溶液在平衡状态下,溶液浓度/盐度在温度一定条件下随相对湿度升高而降低.NaCl溶液的平衡浓度 (C NaCl ,kmol·m-3 ) 与温度 (T ,°C) 及相对湿度 (RH, %) 的关系满足以下公式[11 ] : ...
... 式中,C O 2 -3 ).NaCl溶液中O2 的扩散系数 (D , m2 ·s-1 ) 符合下式[11 ] : ...
Equation for calculating physical properties of sodium chloride solutions
1
1997
... 式中,RH适用区间为[RHsat ,100%).根据文献NaCl溶液密度 (ρ , kg·m-3 ) 与溶液盐度(S , %)和温度(T , °C)满足以下关系[12 ] : ...
氯化钠溶液物性关系式
1
1997
... 式中,RH适用区间为[RHsat ,100%).根据文献NaCl溶液密度 (ρ , kg·m-3 ) 与溶液盐度(S , %)和温度(T , °C)满足以下关系[12 ] : ...
Discrimination on concept of salt effect
1
2013
... 其中,P g 是气相与液相在平衡状态时的气体分压,α 是Bunsen系数 (常数),C g 是气体在水中的浓度.而对于NaCl溶液,受盐析效应[13 ] 影响,氧的溶解度会随体系含盐量增大而降低.不同温度及盐度溶液内的氧溶解度可使用Weiss方程进行精确计算[14 ] .在一定盐度、温度条件下,气体浓度由Van't Hoff方程的积分形式获得,溶液中氧的溶解度 (C O 2 ' 3 ·L-1 ) 与环境温度 (T , °C) 及溶液盐度 (S , ‰) 的关系如下[14 ] : ...
盐效应概念辨析
1
2013
... 其中,P g 是气相与液相在平衡状态时的气体分压,α 是Bunsen系数 (常数),C g 是气体在水中的浓度.而对于NaCl溶液,受盐析效应[13 ] 影响,氧的溶解度会随体系含盐量增大而降低.不同温度及盐度溶液内的氧溶解度可使用Weiss方程进行精确计算[14 ] .在一定盐度、温度条件下,气体浓度由Van't Hoff方程的积分形式获得,溶液中氧的溶解度 (C O 2 ' 3 ·L-1 ) 与环境温度 (T , °C) 及溶液盐度 (S , ‰) 的关系如下[14 ] : ...
The oxygen saturability of sea water and Weiss equation
2
2002
... 其中,P g 是气相与液相在平衡状态时的气体分压,α 是Bunsen系数 (常数),C g 是气体在水中的浓度.而对于NaCl溶液,受盐析效应[13 ] 影响,氧的溶解度会随体系含盐量增大而降低.不同温度及盐度溶液内的氧溶解度可使用Weiss方程进行精确计算[14 ] .在一定盐度、温度条件下,气体浓度由Van't Hoff方程的积分形式获得,溶液中氧的溶解度 (C O 2 ' 3 ·L-1 ) 与环境温度 (T , °C) 及溶液盐度 (S , ‰) 的关系如下[14 ] : ...
... [14 ]: ...
海水的氧饱和度与韦斯方程
2
2002
... 其中,P g 是气相与液相在平衡状态时的气体分压,α 是Bunsen系数 (常数),C g 是气体在水中的浓度.而对于NaCl溶液,受盐析效应[13 ] 影响,氧的溶解度会随体系含盐量增大而降低.不同温度及盐度溶液内的氧溶解度可使用Weiss方程进行精确计算[14 ] .在一定盐度、温度条件下,气体浓度由Van't Hoff方程的积分形式获得,溶液中氧的溶解度 (C O 2 ' 3 ·L-1 ) 与环境温度 (T , °C) 及溶液盐度 (S , ‰) 的关系如下[14 ] : ...
... [14 ]: ...
Interaction between diffusion process and electrode reaction process under convection conditions
1
1957
... 电解质溶液内的O2 在金属表面发生还原反应被消耗,当阴极还原反应速度>氧扩散速度时,还原速度受氧的扩散速度控制,金属界面处O2 浓度为零.根据Fick定律,在单位时间内通过垂直于扩散方向的单位截面积的扩散物质流量与该截面处的浓度梯度成正比.如图5 所示,溶液内气体扩散并出现浓度梯度的现象局限于金属表面一定距离范围内,既存在极限扩散距离 (Nernst扩散层).研究表明[15 ] ,对于静止水溶液内氧的极限扩散距离约400 μm.垂直于金属表面方向的一维扩散流束 (J , mol·m-2 ·s-1 ) 可根据Fick第一定律表达为下式: ...
Study on the oxygen budgets of grass carp ponds and its critical impact factors
1
2012
... 由于大气环境材料表面自然形成的液膜体积有限,伴随腐蚀液膜内的O2 被持续消耗,当溶液内氧的平衡蒸汽压小于空气中氧的分压,既溶解氧浓度低于溶解度时,O2 将由大气自发传递到液膜内.氧的溶解过程是O2 自气相到液相的转移过程,根据双膜理论[16 ] ,O2 的传递速度R O 2
草鱼养殖池塘溶氧收支平衡及关键影响因子的研究
1
2012
... 由于大气环境材料表面自然形成的液膜体积有限,伴随腐蚀液膜内的O2 被持续消耗,当溶液内氧的平衡蒸汽压小于空气中氧的分压,既溶解氧浓度低于溶解度时,O2 将由大气自发传递到液膜内.氧的溶解过程是O2 自气相到液相的转移过程,根据双膜理论[16 ] ,O2 的传递速度R O 2
Metal corrosion rate prediction method and metal corrosion life prediction system
1
2012
... 式中,D 为扩散系数,μ 为溶液粘度,ρ 为溶液密度,g 为重力加速度,T 为温度,Re为Reynolds系数.对于NaCl溶液,氧的溶解速率 (R O 2 -2 ·s-1 ) 可用下式表达[17 ] : ...
Potential control under thin aqueous layers using a Kelvin Probe
1
2007
... 金属大气腐蚀阴极过程反应所需的氧需要由大气/电解质层界面溶解进入液体并扩散至金属表面才能参与反应,Frankel等[18 ] 预测极限扩散电流密度I lim 与液膜厚度呈反比的关系.根据Farday定律,即为在电极界面上发生化学变化物质的质量与通入的电量成正比: ...
The effects of Cl– ion concentration and relative humidity on atmospheric corrosion behaviour of PCB-Cu under adsorbed thin electrolyte layer
1
2011
... 当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制.试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显.另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间.在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果.Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] .Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大.由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异.在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动.腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律. ...
Important influential factor for corrosion of high-altitude marine engineering equipment in atmosphere-chloride ion deposition rate
1
2020
... 当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制.试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显.另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间.在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果.Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] .Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大.由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异.在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动.腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律. ...
海洋工程装备高空腐蚀重要影响因素Cl- 沉降速率研究
1
2020
... 当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制.试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显.另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间.在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果.Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] .Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大.由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异.在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动.腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律. ...
Effect of atmospheric pollutants on the corrosion of high power electrical conductors-Part 2. Pure copper
1
2007
... 当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制.试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显.另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间.在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果.Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] .Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大.由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异.在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动.腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律. ...
Effect of unusually elevated SO2 atmospheric content on the corrosion of high power electrical conductors-Part 3. Pure copper
1
2008
... 当大气腐蚀伴随金属表面覆盖较厚液膜或氧化层时,反应过程受阴极传质控制.试验结果显示随腐蚀时间增加,Cu腐蚀失重速率持续降低,腐蚀过程中Cu表面生成较为致密的金属氧化物层,伴随氧化膜的致密程度与厚度不断增加,氧的扩散过程进一步受阻,阴极控制效果凸显.另一方面,通过极限扩散电流密度计算得到的腐蚀速率远大于试验测量值,试验条件下的液膜厚度较薄、O2 扩散效率高,腐蚀初期金属表面未覆盖氧化膜,可推测初期反应受阳极控制;实际腐蚀测量过程中可通过分析早期腐蚀速率的拐点来明确阳极控制与阴极控制的交换时间.在计算过程中需考虑实际反应速率控制步骤,伴随腐蚀进行需进一步考虑金属表面氧化膜的影响效果.Huang等[19 ] 研究了相对湿度和Cl- 浓度对印刷电路板 (主要组成为Cu) 大气腐蚀行为的影响,随RH和Cl- 浓度的提高,阴极电流密度增大,金属腐蚀加速[20 ] .Vera等[21 ,22 ] 采用ESEM研究了Cu暴露在海洋工业大气下的腐蚀情况,结果表明随污染物浓度增加和暴露时间的延长,腐蚀产物层的厚度和致密性都增大.由于根据金属种类与反应时间变化金属氧化膜的结构致密程度不同,产生的保护性和坚固性亦有差异.在拥有致密氧化膜的金属表面,氧需要通过氧化物层扩散到金属表面或者金属原子穿过氧化物层向溶液一侧扩散才能维持腐蚀继续发生,其扩散机制表现为晶体点阵中邻近的原子或离子相互换位;原子或离子在晶格点阵中空隙间移动;穿过晶格点阵中的空穴移动.腐蚀速率受氧化膜抑制并随时间变化呈抛物线规律. ...