航空工业中,电镀银层是钢制和铜制零件普遍采用的导电、润滑和高温防粘接镀层[1 ] 。长期以来,氰化镀银工艺由于镀液稳定、分散能力好、镀层结晶细致等优势一直被广泛应用。然而,氰化物严重危害人体及环境,因此,开发工艺稳定且环境友好的无氰电镀银体系十分必要。
当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺。
目前,关于DMH体系中Ag的电沉积行为已有报道。朱雅平等[18 ] 通过量子化学计算Ag+ 与DMH形成的配合物的能量,结合循环伏安曲线确定了在不同DMH浓度和pH值下DMH与Ag+ 形成的配合物形式及其稳定性均不同,pH值为10时DMH与Ag+ 能够形成稳定的配合物[Ag(C5 H7 N2 O2 )]和[Ag(C5 H7 N2 O2 )2 ]- 。卢俊峰等[19 ] 通过循环伏安曲线证实DMH镀银体系中银的电沉积符合三维成核机理。然而,总的来说,目前关于DMH体系中银的阴极还原历程及电结晶过程的研究还不够深入,对此研究有利于调控镀层结构及性能。
基于此,本文通过阴极极化、循环伏安、计时电位和电化学阻抗谱等技术系统研究碱性DMH体系中Ag在阴极界面的还原历程,采用计时电流研究该体系中Ag的电化学成核机理,以求为碱性DMH体系中Ag的电沉积研究和工艺调控提供一定的理论参考。
1 实验方法
碱性DMH镀银体系溶液的主要成分为:30 g/L AgNO3 ,100 g/L C5 H8 N2 O2 和80 g/L K2 CO3 ,采用200 g/L的KOH溶液调节pH值至10~11。
利用CHI 604D电化学工作站在无氰镀银溶液中进行各项电化学实验。实验采用三电极体系,铂片作为辅助电极,饱和甘汞电极 (SCE) 作为参比电极,以直径3 mm的玻碳电极为工作电极,实验测量前玻碳电极依次用粒径为0.3和 0.05 μm的 Al2 O3 粉抛光,二次蒸馏水和超声水洗后待用。计时电位曲线是在碱性DMH镀银体系中以不同电流密度 (0.5~0.9 A/dm2 ) 进行,扫描时间为50 s,温度为25 ℃。稳态极化曲线扫描速率为1 mV/s,温度为25 ℃。循环伏安曲线扫描速度为50、30、20和10 mV/s,从开路电位开始扫描,先负扫至-1.15 V再正扫至0.90 V,最后至开路电位为止,温度为25 ℃。电化学阻抗谱 (EIS) 测试扫描频率为105 ~10-2 Hz,振幅为5 mV,测试前工作电极须在镀液中浸泡10 min以稳定开路电位。
2 结果与讨论
2.1 银配离子的主要存在形式的理论计算
根据Ag+ 与C5 H7 N2 O2 - 的各级络合常数与平衡常数的关系[20 ] ,可以得到 式 (1) 和 (2):
c ( [ A g ( C 5 H 7 N 2 O 2 ) ] )
= 3.37 × 10 4 c ( A g + ) c ( C 5 H 7 N 2 O 2 - ) (1)
c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - )
= 3.08 × 10 9 c ( A g + ) [ c ( C 5 H 7 N 2 O 2 - ) ] 2 (2)
根据各离子的平衡态,可列出两个质量平衡方程 (3) 和 (4):
c ( C 5 H 7 N 2 O 2 - ) + c ( [ A g ( C 5 H 7 N 2 O 2 ) ] )
+ 2 c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - ) = 0.78 (3)
c ( A g + ) + c ( [ A g ( C 5 H 7 N 2 O 2 ) ] ) + c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - ) = 0.1766 (4)
将式 (1)、(2) 代入方程 (3)、(4) 中,得到 式 (5) 和 (6):
(5) $\begin{array}{c} c\left(\mathrm{C}_{5} \mathrm{H}_{7} \mathrm{~N}_{2} \mathrm{O}_{2}^{-}\right)+3.37 \times 10^{4} c\left(\mathrm{Ag}^{+}\right) c\left(\mathrm{C}_{5} \mathrm{H}_{7} \mathrm{~N}_{2} \mathrm{O}_{2}^{-}\right)+2 \times \\ 3.08 \times 10^{9} c\left(\mathrm{Ag}^{+}\right)\left[c\left(\mathrm{C}_{5} \mathrm{H}_{7} \mathrm{~N}_{2} \mathrm{O}_{2}^{-}\right)\right]^{2}=0.78 \end{array}$
c ( A g + ) + 3.37 × 10 4 c ( A g + ) c ( C 5 H 7 N 2 O 2 - )
+ 3.08 × 10 9 c ( A g + ) [ c ( C 5 H 7 N 2 O 2 - ) ] 2 = 0.1766 (6)
将 式 (6) 代入 式 (5),得到 式 (7):
3.08 × 10 9 [ c ( C 5 H 7 N 2 O 2 - ) ] 3
- 1.315 × 10 4 [ c ( C 5 H 7 N 2 O 2 - ) ] 2
- 2.033 × 10 4 c ( C 5 H 7 N 2 O 2 - ) - 0.78 = 0 (7)
通过牛顿迭代法计算得到c (C5 H7 N2 O2 - ) 浓度为0.4270 mol/L,代入得到c (Ag+ )浓度为3.15×10-10 mol/L,c ([Ag(C5 H7 N2 O2 )])浓度为4.533×10-6 mol/L,c ([Ag(C5 H7 N2 O2 )2 ]- )浓度为0.1769 mol/L。即,c ([Ag(C5 H7 N2 O2 )2 ]- )、c ([Ag(C5 H7 N2 O2 )])和c (Ag+ )在体系中的比例分别为99.99%、0.0026%和(1.78×10-7 )%,由此确定碱性DMH体系中Ag主要以[Ag(C5 H7 N2 O2 )2 ]- 形式存在。
2.2 银配离子的主要存在形式的实验验证
文献证实Ag+ 与C5 H8 N2 O2 能形成多种配位体[18 ~20 ] 。假设在溶液中银配离子的主要存在形式为[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n
[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n + e ⇌ A g + n C 5 H 7 N 2 O 2 - (8)
E e = E θ - R T F l n [ C 5 H 7 N 2 O 2 - ] n [ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n (9)
式中,E e 为反应平衡电极电势,Eθ 为反应标准电极电势,F 为Faraday常数,R 为气体常数,T 为温度。
在[Ag(C5 H7 N2 O2 )n ]1- n
∂ E 平 ∂ l n c ( C 5 H 7 N 2 O 2 - ) = - n R T F (10)
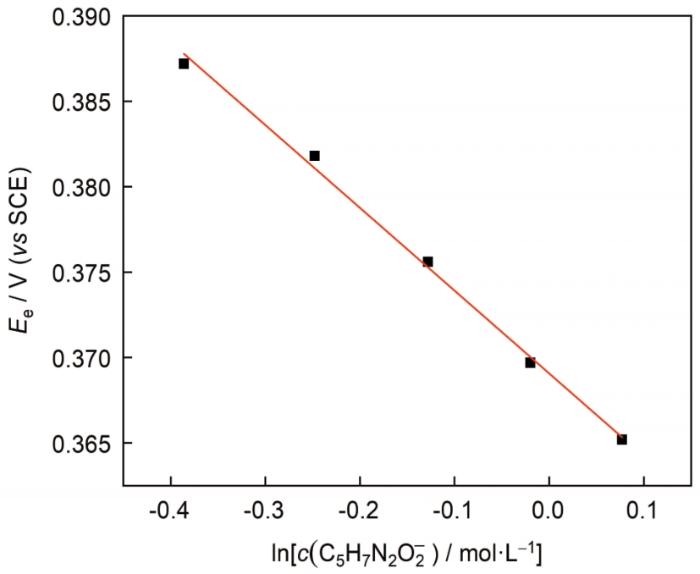
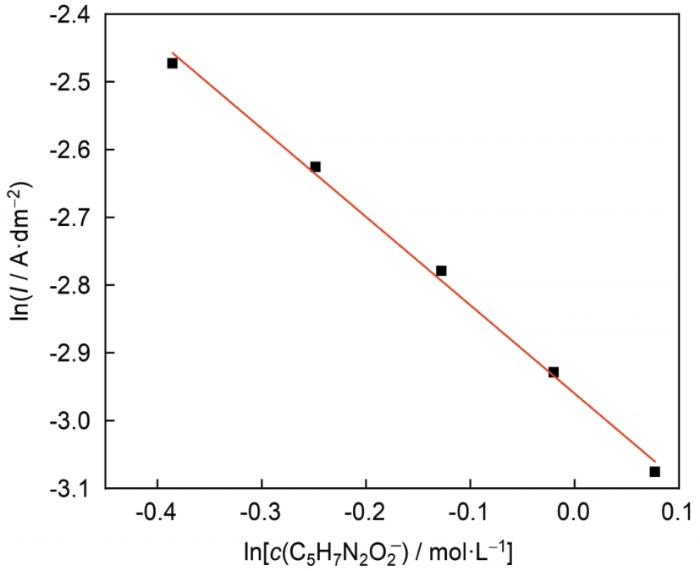
从 式 (10) 可以看出,E 平 与lnc (C5 H7 N2 O2 - ) 之间将存在线性关系,根据直线的斜率可以求出n 值。本文测量了较低浓度的AgNO3 含量 (0.01 mol/L) 和较高浓度的C5 H8 N2 O2 含量 (0.68、0.78、0.88、0.98和1.08 mol/L) 时该体系的Tafel曲线。根据Tafel曲线外推法对极化曲线进行拟合,得出了不同C5 H8 N2 O2 含量时该体系的平衡电势,见图1 。
图1
图1
平衡电势E e 与lnc (C5 H7 N2 O2 - ) 的关系曲线
Fig.1
Relationship between lnc (C5 H7 N2 O2 - ) and equilibrium potential
由图1 可知,平衡电势E平 与lnc (C5 H7 N2 O2 - ) 成线性关系,直线斜率为-0.0484,代入 式(10)得出n =1.88≈2,即,碱性DMH镀银体系中银配离子的主要存在形式为[Ag(C5 H7 N2 O2 )2 ]- ,此与上述理论计算的结果相一致。
2.3 电沉积前置反应的判断
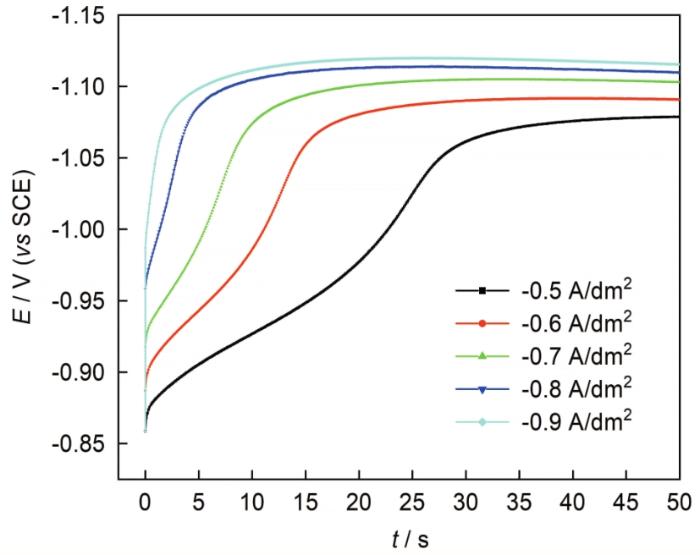
为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 。由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] 。根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] 。
图2
图2
碱性DMH体系中银电沉积的计时电位曲线
Fig.2
Chronopotentiometric curves of silver electrodeposition in alkaline DMH solutions
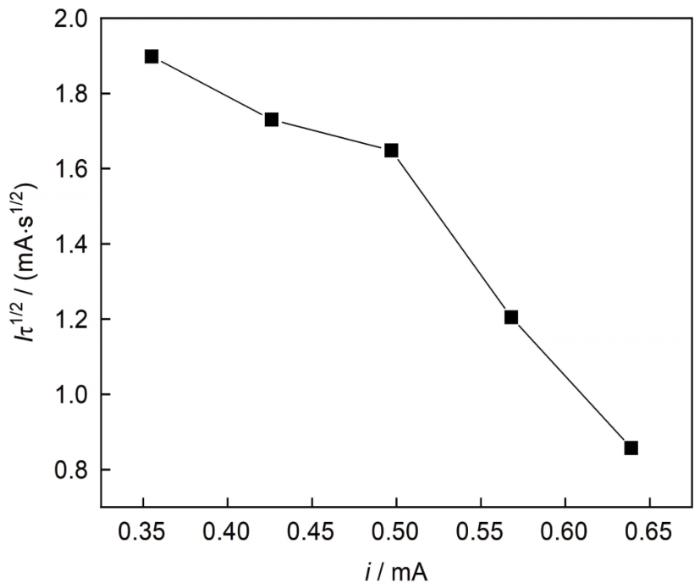
从图2 可以读取不同电流密度下银电沉积的过渡时间τ ,并根据玻碳电极面积 (S =0.071 cm2 ),计算得到电流i 和I τ1/2 ;对不同电流密度条件下银电沉积过程的Iτ 1/2 ~i 作图,结果见图3 。由图可知,Iτ 1/2 与电流i 之间并非平行于电流坐标的直线,表明碱性DMH镀银体系中Ag的电沉积过程存在前置转化反应[22 , 23 ] 。
图3
图3
I τ1/2 ~i 关系曲线
Fig.3
Relationship curve between I τ1/2 and i
2.4 阴极界面直接放电配离子
在电极反应过程中,假定DMH体系中[Ag(C5 H7 N2 O2 )2 ]- 通过前置转化反应生成直接放电离子[Ag(C5 H7 N2 O2 )n ]1- n
[ A g ( C 5 H 7 N 2 O 2 ) 2 ] - [ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n
+ ( 2 - n ) C 5 H 7 N 2 O 2 - (11)
[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n + e ↔ k 3 A g + n C 5 H 7 N 2 O 2 - (12)
i = n F k 3 c ( A g C 5 H 7 N 2 O 2 n 1 - n ) · e x p ( - α E F R T ) (13)
k 1 c A g C 5 H 7 N 2 O 2 n 1 - n · [ c ( C 5 H 7 N 2 O 2 - ) ] 2 - n
= k 2 c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - ) (14)
c A g C 5 H 7 N 2 O 2 n 1 - n = k 2 k 1 · c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - ) [ c ( C 5 H 7 N 2 O 2 - ) ] 2 - n (15)
将 式 (15) 带入 式 (13) 得到 式 (16):
i = n F k 3 k 2 k 1 · c ( [ A g ( C 5 H 7 N 2 O 2 ) 2 ] - ) [ c ( C 5 H 7 N 2 O 2 - ) ] 2 - n · e x p ( - α E F R T ) (16)
研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为:
i = n F k 3 k 2 k 1 · c ( A g + ) c [ C 5 H 7 N 2 O 2 - ] 2 - n · e x p ( - α E F R T ) (17)
在温度等条件不变时,忽略活度的影响,c (C5 H7 N2 O2 - ) 对i 的影响为:
∂ l n i ∂ l n [ c C 5 H 7 N 2 O 2 - ] = n - 2 (18)
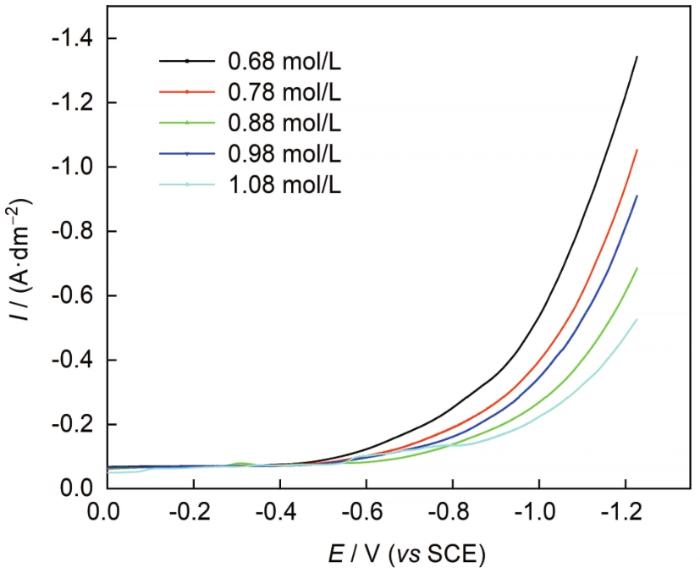
图4 为不同DMH含量下镀液的阴极极化曲线。由图4 可以看出,在约-0.50 V时,阴极界面开始出现放电电流,且无明显的浓差极化,因此选择在此电位下分析DMH浓度与放电电流密度之间的关系。图5 为-0.50 V时lnI 与ln[c (C5 H7 N2 O2 - ) ]之间的关系曲线,从图中可以看出,lnI 与ln[c (C5 H7 N2 O2 - ) ]之间呈线性关系,斜率约为-1,代入 式 (18),求得n =1;因此,在阴极上直接放电的银配离子形式为[Ag(C5 H7 N2 O2 )],同时也证明DMH体系中银的电沉积过程确实存在前置转化反应。
图4
图4
不同DMH含量下镀液的阴极极化曲线
Fig.4
Cathodic polarization curves of bath systems with different DMH content
图5
图5
-0.50 V电位条件下lnI 与ln[c (C5 H7 N2 O
Fig.5
Relationship curve between lnI and ln[c (C5 H7 N2 O
2.5 银电沉积循环伏安行为研究
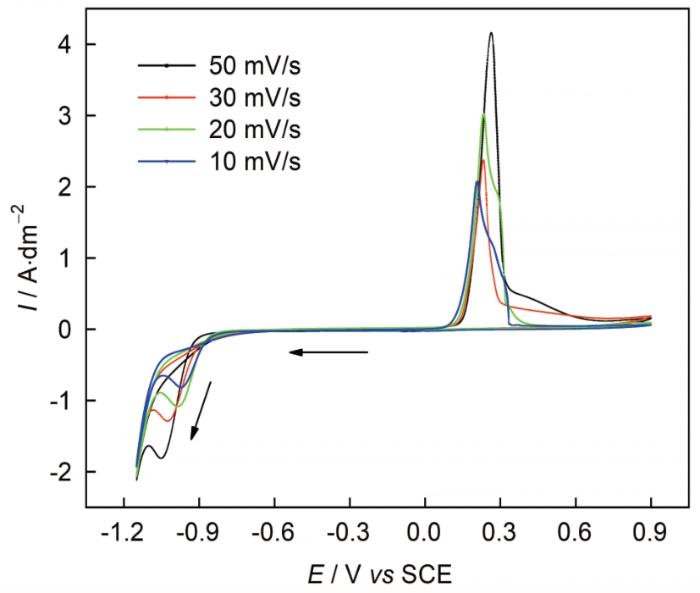
图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线。扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零。电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动。换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV。
图6
图6
玻碳电极上Ag沉积的循环伏安曲线
Fig.6
Cyclic voltammetry of Ag deposition on glassy carbon electrode
此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 。由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应。
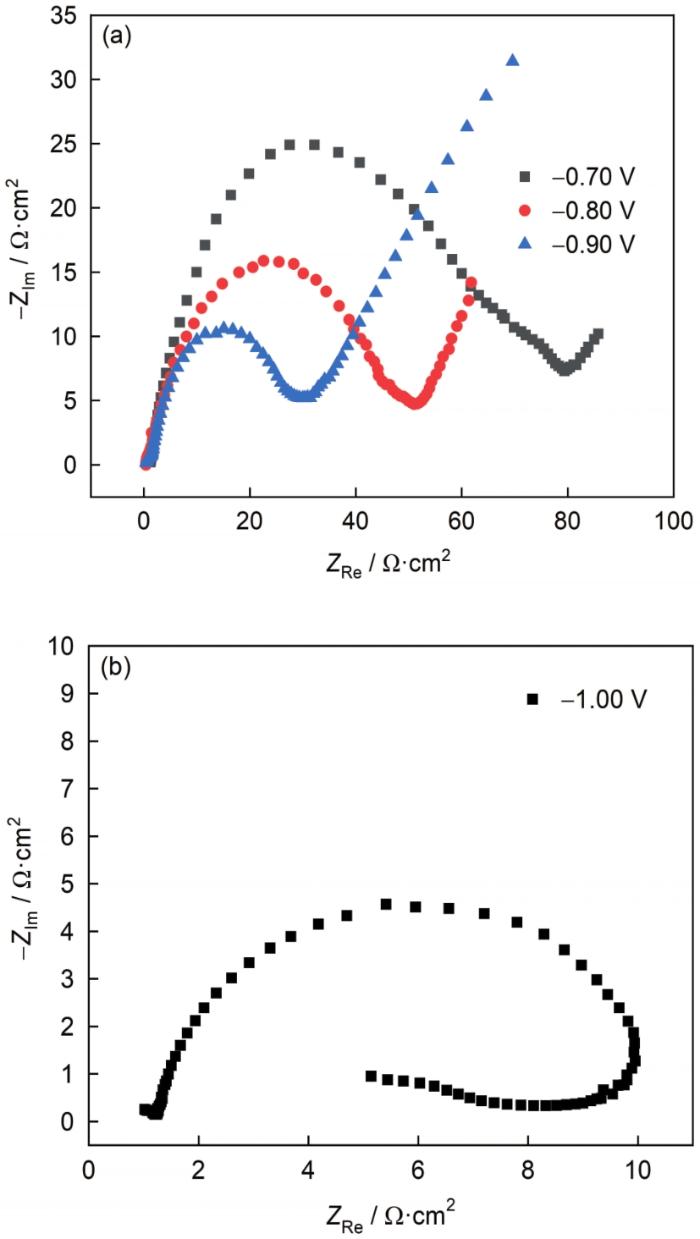
2.6 银电沉积的电化学阻抗谱研究
图7 为不同电位下碱性DMH体系中银电沉积的电化学阻抗谱。从图7a 可以看出,当施加电位为-0.70~-0.90 V时,交流阻抗谱高频区均表现为一个近似半圆的容抗弧,但随着过电位增大,容抗弧的曲率半径逐渐减小;而低频端呈现出一条倾斜角接近45°的直线,且电位越负、Warburg阻抗直线越明显。一般认为,高频容抗弧源于电荷转移及与电极表面的双电层电容,低频阻抗反映电沉积过程的速度控制步骤[23 , 26 ] 。由此可知,碱性DMH镀银体系中银配离子[Ag(C5 H7 N2 O2 )]经历了放电过程;在-0.70~-0.80 V下,过电位较小,电极表面电结晶较慢,阴极放电过程受到电荷转移与扩散的混合控制;当过电位增大,阴极表面上提供成核的能量增加,形核更加容易,故而电沉积的电荷转移电阻也随之减小,-0.90 V下阴极反应也转为浓差极化控制。
图7
图7
不同沉积电位下银沉积过程的电化学阻抗谱
Fig.7
Electrochemical impedance spectroscopy for the electrodeposition of silver at -0.70~-0.90 V (a) and -1.00 V (b) deposition potentials
然而,当施加电位降为-1.00 V时,电化学阻抗谱低频区发生了明显变化,出现了一个感抗弧,如图7b 所示;此表明电沉积过程中可能有中间产物吸附在电极表面[23 , 27 ] 。分析认为此电位下,[Ag(C5 H7 N2 O2 )]经放电还原为Ag原子,但Ag原子无法持续进入晶格而造成其电极表面吸附;此外,高过电位下析氢反应加剧而产生大量气泡,加之Ag的沉积速度极快,电极表面的阴极电流分布极其不均匀也是造成此现象的重要原因。
2.7 银的电化学成核机理
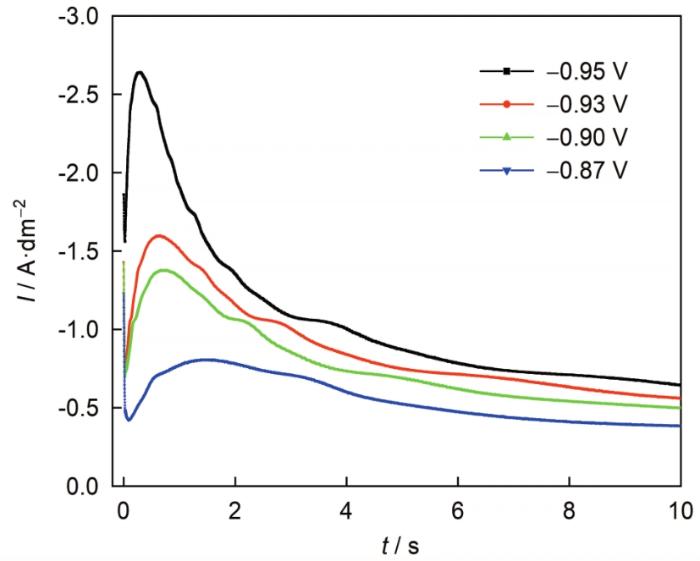
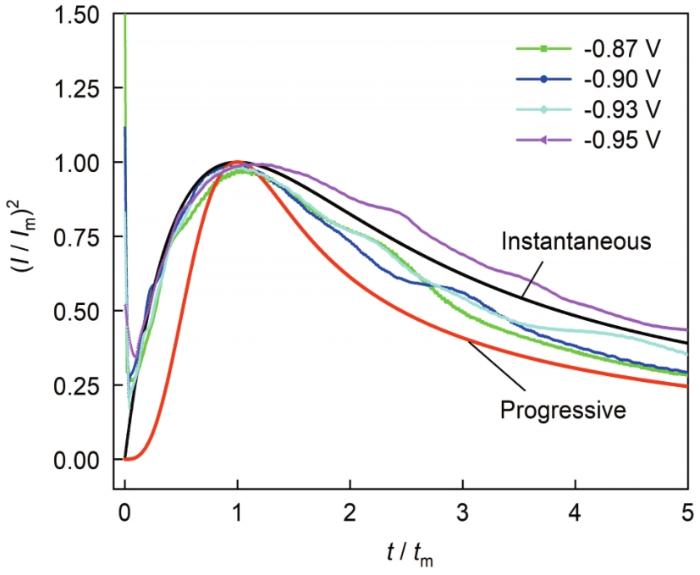
循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息。因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程。据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] 。
图8
图8
碱性DMH体系中银电沉积的电流密度-时间暂态曲线
Fig.8
Current time transient curve for the electrodeposition of silver from alkaline DMH bath
然而,不同阶跃电位下双电层充电时间和峰值电流密度存在明显差别。由图8 可知,随着阶跃电位的负移,双电层充电过程的充电时间明显减小,峰值电流密度明显增大,同时成核驰豫时间也明显减小。分析认为,随着阶跃电位的负移,过电位持续增加,双电层充电越来越快,导致成核速率加快,也更易达到电流峰值。
根据Scharifker三维多核生长模型[28 ] ,其瞬时成核和连续成核机理的无因次方程为:
(19) I 2 I m 2 = 1.9542 t t m 1 - e x p - 1.2564 t t m 2
(20) I 2 I m 2 = 1.2254 t t m 1 - e x p - 2.3367 t t m 2 2
式中,I 为电流密度,t 为时间,I m 为最大电流密度,t m 为达到I m 的时间。
按照式 (19) 和 (20),对图8 中的数据进行拟合,可得到三维半球模型的理论成核曲线;同时,将图8 中的数据进行无量纲处理,绘制出I 2 /I m 2 t /t m 曲线,并与理论成核曲线对比,结果见图9 。可以看出,-0.87~-0.95 V的阶跃电位下,银电结晶时的无因次I 2 /I m 2 ~t /t m 曲线都更接近于瞬时成核理论曲线,表明碱性DMH体系中银配离子的电沉积遵循三维瞬时成核机理;成核之后的扩散控制过程偏离理论曲线,可能与银电沉积过程中伴随的析氢有关。
图9
图9
电流-时间暂态曲线的无因次曲线图
Fig.9
The non-dimensional polts of (I /I m )2 ~t / t m
综合上述分析可知,在碱性DMH镀银体系中,银配离子的主要存在形式为[Ag(C5 H7 N2 O2 )2 ]- ,但是在阴极界面直接放电还原的银配离子为[Ag(C5 H7 N2 O2 )];电沉积反应存在[Ag(C5 H7 N2 O2 )2 ]- 转为[Ag(C5 H7 N2 O2 )]的前置转化反应;银配离子[Ag(C5 H7 N2 O2 )]得到电子还原为Ag;该体系的阴极还原过程为:
[ A g ( C 5 H 7 N 2 O 2 ) 2 ] - [ A g C 5 H 7 N 2 O 2 ]
+ C 5 H 7 N 2 O 2 - (21)
[ A g C 5 H 7 N 2 O 2 ] + e A g + C 5 H 7 N 2 O 2 - (22)
3 结论
(1) 碱性DMH镀银体系中银配离子的主要存在形式为[Ag(C5 H7 N2 O2 )2 ]- ,其通过前置转化反应生成[Ag(C5 H7 N2 O2 )]并在阴极上直接放电。
(2) 循环伏安曲线和电化学阻抗谱测试结果表明,碱性DMH体系中Ag的电沉积过程为不可逆反应且受扩散过程控制。在电位为-0.70~-1.00 V范围内,随着过电位增大,电沉积的电荷转移电阻随之减小,银更容易沉积。
(3) 循环伏安曲线和计时电流曲线测试结果表明,碱性DMH体系中Ag的电沉积经历了晶核形成过程,且其电结晶遵循三维瞬时成核机理。
参考文献
View Option
[1]
Zhou Y L Huo Y J The comparison of electrochemical migration mechanism between electroless silver plating and silver electroplating
[J]. J. Mater. Sci. Mater. Electron. , 2016 , 27 : 931
DOI
URL
[本文引用: 3]
[2]
Ren F Z Yin L T Wang S S et al Cyanide-free silver electroplating process in thiosulfate bath and microstructure analysis of Ag coatings
[J]. Trans. Nonferrous. Met. Soc. China , 2013 , 23 : 3822
DOI
URL
[本文引用: 1]
[3]
Satpathy B Jena S Das S et al A comparative study of electrodeposition routes for obtaining silver coatings from a novel and environment-friendly thiosulphate-based cyanide-free electroplating bath
[J]. Surf. Coat. Technol. , 2021 , 424 : 127680
DOI
URL
[4]
Hubin A Vereecken J Electrochemical reduction of silver thiosulphate complexes Part II Mechanism and kinetics
[J]. J. Appl. Electrochem. , 1994 , 24 : 396
[本文引用: 3]
[5]
Wei L A Cleaner production technology of non-cyanide silver plating
[J]. Electroplat. Finish. , 2004 , 23 (5 ) : 27
[本文引用: 1]
魏立安 无氰镀银清洁生产技术
[J]. 电镀与涂饰 , 2004 , 23 (5 ): 27
[本文引用: 1]
[6]
Liu A M Ren X F Zhang J et al A composite additive used for an excellent new cyanide-free silver plating bath
[J]. New J. Chem. , 2015 , 39 : 2409
DOI
URL
[本文引用: 1]
[7]
Bai Z X Huang S R Non-cyanide bright silver plating
[J]. Electroplat. Pollut. Control , 2001 , 21 (1 ): 21
[本文引用: 1]
白祯遐 , 黄锁让 无氰光亮镀银
[J]. 电镀与环保 , 2001 , 21 (1 ): 21
[本文引用: 1]
[8]
Gan H Y Liu G M Huang C H et al The influence of pH and current density for nano-silver electrodeposited in cyanide-free succinimide bath
[J]. Surf. Interf. , 2021 , 27 : 101487
[本文引用: 2]
[9]
Bi C Liu D F Zeng Q Y Research on additives for succinimide cyanide-free silver electroplating
[J]. Electroplat. Finish. , 2016 , 35 (3 ): 131
毕 晨 , 刘定富 , 曾庆雨 丁二酰亚胺体系无氰镀银添加剂的研究
[J]. 电镀与涂饰 , 2016 , 35 (3 ): 131
[10]
Gan H Y Liu G M Huang C H et al Effect of auxiliary complexant on properties of silver coatings electroplated from cyanide-free succinimide bath
[J]. Electroplat. Finish. , 2020 , 39 : 1457
[本文引用: 2]
甘鸿禹 , 刘光明 , 黄超华 等 辅助配位剂对丁二酰亚胺无氰镀银层性能的影响
[J]. 电镀与涂饰 , 2020 , 39 : 1457
[本文引用: 2]
[11]
Liu A M Ren X F Wang B et al Complexing agent study via computational chemistry for environmentally friendly silver electrodeposition and the application of a silver deposit
[J]. RSC Adv. , 2014 , 4 : 40930
DOI
URL
[本文引用: 1]
[12]
Song W X Li T T Ma J Y et al Effect of current density on silver electroplating in nicotinic acid system
[J]. Electroplat. Finish. , 2018 , 37 : 201
[本文引用: 1]
宋伟星 , 李涛涛 , 马进宇 等 电流密度对烟酸体系电镀银的影响
[J]. 电镀与涂饰 , 2018 , 37 : 201
[本文引用: 1]
[13]
Liu A M Ren X F Wang C et al DMH and NA-based cyanide-free silver electroplating bath: a promising alternative to cyanide ones in microelectronics
[J]. Ionics , 2021 , 27 : 417
DOI
[本文引用: 5]
[14]
Hajiahmadi Z Tavangar Z Proposing a new complexing agent for cyanide-free silver electroplating through a comprehensive computational study of dimethyl hydantoin
[J]. Mol. Simulat. , 2021 , 47 : 619
DOI
URL
[15]
Liu A M Ren X F Jie Z et al Complexing agent study for environmentally friendly silver electrodeposition (II): electrochemical behavior of silver complex
[J]. RSC Adv. , 2016 , 6 : 7348
DOI
URL
[本文引用: 1]
[16]
Oyaizu K Ohtani Y Shiozawa A et al Highly stable gold (III) complex with a hydantoin ligand in alkaline media
[J]. Inorg. Chem. , 2005 , 44 : 6915
DOI
URL
[17]
Pizzetti F Salvietti E Giurlani W et al Cyanide-free silver electrodeposition with polyethyleneimine and 5,5-dimethylhydantoin as organic additives for an environmentally friendly formulation
[J]. J. Electroanal. Chem. , 2022 , 911 : 116196
DOI
URL
[本文引用: 2]
[18]
Zhu Y P Wang W Effects of concentration of 5,5-dimethylhydantoin as complexing agent and pH value of plating bath on electrodeposition of Silver
[J]. Mater. Prot. , 2015 , 48 (1 ): 1
[本文引用: 3]
朱雅平 , 王 为 银的电沉积过程与5,5-二甲基乙内酰脲配位剂浓度及pH值的关系
[J]. 材料保护 , 2015 , 48 (1 ): 1
[本文引用: 3]
[19]
Lu J Non-cyanide silver electroplating using DMH as complexing agent and investigation on electrodeposition behaviors
[D]. Harbin : Harbin Institute of Technology , 2007
[本文引用: 7]
卢俊峰 基于DMH为配位剂的无氰电镀银工艺及电沉积行为研究
[D]. 哈尔滨 : 哈尔滨工业大学 , 2007
[本文引用: 7]
[20]
Pavlovich G Z Luthy R G Complexation of metals with hydantoins
[J]. Water Res. , 1988 , 22 : 327
DOI
URL
[本文引用: 2]
[21]
Liao C F Fang M Z Wang X et al Chronoamperometry and chronopotentiometry curves of NaCl-KCl-Na2 WO4 eutectic system
[J]. Chin. J. Rare Met. , 2016 , 40 : 784
[本文引用: 2]
廖春发 , 房孟钊 , 王 旭 等 NaCl-KCl-Na2 WO4 共融体系的计时电流与计时电位曲线分析
[J]. 稀有金属 , 2016 , 40 : 784
[本文引用: 2]
[22]
Yang Y F Gong Z Q Li Q G Electrochemical deposition of trivalent chromium
[J]. J. Cent. South Univ. (Sci. Technol.) , 2008 , 39 : 112
[本文引用: 4]
杨余芳 , 龚竹青 , 李强国 三价铬的电化学沉积
[J]. 中南大学学报 (自然科学版) , 2008 , 39 : 112
[本文引用: 4]
[23]
Li Y Y Du N Shu W F et al Electrodeposition behavior of zine in alkaline zincate electrolyte
[J]. J. Chin. Soc. Corros. Prot. , 2014 , 34 : 89
[本文引用: 5]
李园园 , 杜 楠 , 舒伟发 等 碱性锌酸盐体系中Zn的电沉积行为研究
[J]. 中国腐蚀与防护学报 , 2014 , 34 : 89
DOI
[本文引用: 5]
通过循环伏安、计时电位及电化学阻抗谱技术研究了碱性锌酸盐体系中Zn的阴极还原历程,采用计时电流法结合扫描电镜 (SEM) 研究了Zn的电化学成核机理。结果表明:溶液中Zn主要以Zn(OH)<sub>4</sub><sup>2-</sup>形式存在,Zn(OH)<sub>4</sub><sup>2-</sup>通过前置转化反应生成Zn(OH)<sub>2</sub>;Zn(OH)<sub>2</sub>在阴极界面上分两步放电,第一步放电后生成Zn(OH)<sub>ad</sub>吸附在电极表面,而后经第二步放电还原为Zn,两步均不可逆。外加电位为-1.40~-1.50 V时,体系中仅发生Zn(OH)<sub>2</sub>的第一步放电反应;电位负移至-1.60 V时,Zn(OH)<sub>2</sub>经历了两步放电过程,但Zn仅吸附在电极表面,电沉积过程处于一种非稳态;当电位负移至-1.70~-1.80 V时,吸附态Zn才持续进入晶格形成完整镀层。体系中Zn的电结晶过程遵循三维连续形核方式。
[24]
Liu Y Q Liu G M Fan W X et al Effect of polyethylene glycol-600 on acidic Zn-Ni alloy electroplating and its corrosion resistance
[J]. J. Chin. Soc. Corros. Prot. , 2022 , 42 : 235
[本文引用: 2]
刘永强 , 刘光明 , 范文学 等 聚乙二醇-600对酸性Zn-Ni合金的电沉积行为及镀层耐蚀性影响的研究
[J]. 中国腐蚀与防护学报 , 2022 , 42 : 235
DOI
[本文引用: 2]
采用循环伏安 (CV) 曲线研究了聚乙二醇-600 (PEG-600) 在酸性Zn-Ni合金基础镀液中对Zn-Ni合金电沉积行为的影响;采用电化学阻抗谱 (EIS)、动电位极化曲线与表面形貌分析方法研究了酸性Zn-Ni合金基础镀液中,聚乙二醇-600的浓度对Zn-Ni合金镀层表面微观形貌及耐蚀性的影响。结果表明,PEG-600作为一种非离子型表面活性剂,在基体镀件表面具有较强的吸附能力,基础镀液中添加PEG-600会影响Zn-Ni合金的电沉积过程,使Zn<sup>2+</sup>与Ni<sup>2+</sup>更难迁移至镀件表面,导致Zn-Ni合金的共沉积峰位置向更负电位方向移动,从而使阴极过电位升高。基础镀液中随PEG-600浓度的增加,电沉积所得Zn-Ni合金镀层的耐蚀性呈先增大后减小的趋势。当PEG-600浓度为3.33×10<sup>-2</sup> mol/L时,Zn-Ni合金镀层耐蚀性能达到最佳,其电化学阻抗模值为1960 Ω·cm<sup>2</sup>、自腐蚀电流为1.97×10<sup>-5</sup> A·cm<sup>-2</sup>,并且能得到均一的金属间化合物γ相和最优的表面微观形貌。
[25]
Bonou L Eyraud M Crousier J Nucleation and growth of copper on glassy carbon and steel
[J]. J. Appl. Electrochem. , 1994 , 24 : 906
DOI
URL
[本文引用: 2]
[26]
Cao C N Zhang J Q An Introduction to Electrochemical Impedance Spectroscopy [M]. Beijing : Science Press , 2002
[本文引用: 1]
曹楚南 , 张鉴清 电化学阻抗谱导论 [M]. 北京 : 科学出版社 , 2002
[本文引用: 1]
[27]
Peng W J Wang Y Y Mechanism of zinc electroplating in alkaline zincate solution
[J]. J. Cent. South Univ. Technol. , 2007 , 14 (1 ): 37
DOI
URL
[本文引用: 1]
[28]
Scharifker B Hills G Theoretical and experimental studies of multiple nucleation
[J]. Electrochim. Acta , 1983 , 28 : 879
DOI
URL
[本文引用: 1]
The comparison of electrochemical migration mechanism between electroless silver plating and silver electroplating
3
2016
... 航空工业中,电镀银层是钢制和铜制零件普遍采用的导电、润滑和高温防粘接镀层[1 ] .长期以来,氰化镀银工艺由于镀液稳定、分散能力好、镀层结晶细致等优势一直被广泛应用.然而,氰化物严重危害人体及环境,因此,开发工艺稳定且环境友好的无氰电镀银体系十分必要. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
Cyanide-free silver electroplating process in thiosulfate bath and microstructure analysis of Ag coatings
1
2013
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
A comparative study of electrodeposition routes for obtaining silver coatings from a novel and environment-friendly thiosulphate-based cyanide-free electroplating bath
0
2021
Electrochemical reduction of silver thiosulphate complexes Part II Mechanism and kinetics
3
1994
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
Cleaner production technology of non-cyanide silver plating
1
2004
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
无氰镀银清洁生产技术
1
2004
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
A composite additive used for an excellent new cyanide-free silver plating bath
1
2015
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
Non-cyanide bright silver plating
1
2001
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
无氰光亮镀银
1
2001
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
The influence of pH and current density for nano-silver electrodeposited in cyanide-free succinimide bath
2
2021
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
Research on additives for succinimide cyanide-free silver electroplating
0
2016
Effect of auxiliary complexant on properties of silver coatings electroplated from cyanide-free succinimide bath
2
2020
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
辅助配位剂对丁二酰亚胺无氰镀银层性能的影响
2
2020
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
Complexing agent study via computational chemistry for environmentally friendly silver electrodeposition and the application of a silver deposit
1
2014
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
Effect of current density on silver electroplating in nicotinic acid system
1
2018
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
电流密度对烟酸体系电镀银的影响
1
2018
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
DMH and NA-based cyanide-free silver electroplating bath: a promising alternative to cyanide ones in microelectronics
5
2021
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... [13 , 15 , 22 ~24 ],形核过电位达到170 mV. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
Proposing a new complexing agent for cyanide-free silver electroplating through a comprehensive computational study of dimethyl hydantoin
0
2021
Complexing agent study for environmentally friendly silver electrodeposition (II): electrochemical behavior of silver complex
1
2016
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
Highly stable gold (III) complex with a hydantoin ligand in alkaline media
0
2005
Cyanide-free silver electrodeposition with polyethyleneimine and 5,5-dimethylhydantoin as organic additives for an environmentally friendly formulation
2
2022
... 当前主要的无氰镀银体系有硫代硫酸盐体系[2 ~5 ] 、亚氨基二磺酸铵 (NS) 体系[6 , 7 ] 、丁二酰亚胺体系[8 ~10 ] 、烟酸体系[11 , 12 ] 、5,5-二甲基乙内酰脲 (DMH) 体系[13 ~17 ] 等;其中,以DMH为络合剂的碱性无氰镀银体系具有镀液性能稳定、前处理简便、分散能力与覆盖能力佳等优点,最有可能替代氰化物镀银工艺. ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
Effects of concentration of 5,5-dimethylhydantoin as complexing agent and pH value of plating bath on electrodeposition of Silver
3
2015
... 目前,关于DMH体系中Ag的电沉积行为已有报道.朱雅平等[18 ] 通过量子化学计算Ag+ 与DMH形成的配合物的能量,结合循环伏安曲线确定了在不同DMH浓度和pH值下DMH与Ag+ 形成的配合物形式及其稳定性均不同,pH值为10时DMH与Ag+ 能够形成稳定的配合物[Ag(C5 H7 N2 O2 )]和[Ag(C5 H7 N2 O2 )2 ]- .卢俊峰等[19 ] 通过循环伏安曲线证实DMH镀银体系中银的电沉积符合三维成核机理.然而,总的来说,目前关于DMH体系中银的阴极还原历程及电结晶过程的研究还不够深入,对此研究有利于调控镀层结构及性能. ...
... 文献证实Ag+ 与C5 H8 N2 O2 能形成多种配位体[18 ~20 ] .假设在溶液中银配离子的主要存在形式为[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
银的电沉积过程与5,5-二甲基乙内酰脲配位剂浓度及pH值的关系
3
2015
... 目前,关于DMH体系中Ag的电沉积行为已有报道.朱雅平等[18 ] 通过量子化学计算Ag+ 与DMH形成的配合物的能量,结合循环伏安曲线确定了在不同DMH浓度和pH值下DMH与Ag+ 形成的配合物形式及其稳定性均不同,pH值为10时DMH与Ag+ 能够形成稳定的配合物[Ag(C5 H7 N2 O2 )]和[Ag(C5 H7 N2 O2 )2 ]- .卢俊峰等[19 ] 通过循环伏安曲线证实DMH镀银体系中银的电沉积符合三维成核机理.然而,总的来说,目前关于DMH体系中银的阴极还原历程及电结晶过程的研究还不够深入,对此研究有利于调控镀层结构及性能. ...
... 文献证实Ag+ 与C5 H8 N2 O2 能形成多种配位体[18 ~20 ] .假设在溶液中银配离子的主要存在形式为[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
Non-cyanide silver electroplating using DMH as complexing agent and investigation on electrodeposition behaviors
7
2007
... 目前,关于DMH体系中Ag的电沉积行为已有报道.朱雅平等[18 ] 通过量子化学计算Ag+ 与DMH形成的配合物的能量,结合循环伏安曲线确定了在不同DMH浓度和pH值下DMH与Ag+ 形成的配合物形式及其稳定性均不同,pH值为10时DMH与Ag+ 能够形成稳定的配合物[Ag(C5 H7 N2 O2 )]和[Ag(C5 H7 N2 O2 )2 ]- .卢俊峰等[19 ] 通过循环伏安曲线证实DMH镀银体系中银的电沉积符合三维成核机理.然而,总的来说,目前关于DMH体系中银的阴极还原历程及电结晶过程的研究还不够深入,对此研究有利于调控镀层结构及性能. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
... [19 ],所以 式 (16) 应该为: ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... , 19 , 22 ~24 ];当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... 此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 .由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
基于DMH为配位剂的无氰电镀银工艺及电沉积行为研究
7
2007
... 目前,关于DMH体系中Ag的电沉积行为已有报道.朱雅平等[18 ] 通过量子化学计算Ag+ 与DMH形成的配合物的能量,结合循环伏安曲线确定了在不同DMH浓度和pH值下DMH与Ag+ 形成的配合物形式及其稳定性均不同,pH值为10时DMH与Ag+ 能够形成稳定的配合物[Ag(C5 H7 N2 O2 )]和[Ag(C5 H7 N2 O2 )2 ]- .卢俊峰等[19 ] 通过循环伏安曲线证实DMH镀银体系中银的电沉积符合三维成核机理.然而,总的来说,目前关于DMH体系中银的阴极还原历程及电结晶过程的研究还不够深入,对此研究有利于调控镀层结构及性能. ...
... 研究证实电沉积体系中金属离子往往与络合剂形成金属配离子[1 ~4 , 8 ~10 , 13 ~19 ] ;在DMH镀银体系中,即使DMH含量过量,但有效的DMH浓度(c ([C5 H7 N2 O2 - ]2- n [19 ] ,所以 式 (16) 应该为: ...
... [19 ],所以 式 (16) 应该为: ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... , 19 , 22 ~24 ];当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... 此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 .由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
Complexation of metals with hydantoins
2
1988
... 根据Ag+ 与C5 H7 N2 O2 - 的各级络合常数与平衡常数的关系[20 ] ,可以得到 式 (1) 和 (2): ...
... 文献证实Ag+ 与C5 H8 N2 O2 能形成多种配位体[18 ~20 ] .假设在溶液中银配离子的主要存在形式为[ A g ( C 5 H 7 N 2 O 2 ) n ] 1 - n
Chronoamperometry and chronopotentiometry curves of NaCl-KCl-Na2 WO4 eutectic system
2
2016
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 .由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应. ...
NaCl-KCl-Na2 WO4 共融体系的计时电流与计时电位曲线分析
2
2016
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 .由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应. ...
Electrochemical deposition of trivalent chromium
4
2008
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 从图2 可以读取不同电流密度下银电沉积的过渡时间τ ,并根据玻碳电极面积 (S =0.071 cm2 ),计算得到电流i 和I τ1/2 ;对不同电流密度条件下银电沉积过程的Iτ 1/2 ~i 作图,结果见图3 .由图可知,Iτ 1/2 与电流i 之间并非平行于电流坐标的直线,表明碱性DMH镀银体系中Ag的电沉积过程存在前置转化反应[22 , 23 ] . ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... , 22 ~24 ],形核过电位达到170 mV. ...
三价铬的电化学沉积
4
2008
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 从图2 可以读取不同电流密度下银电沉积的过渡时间τ ,并根据玻碳电极面积 (S =0.071 cm2 ),计算得到电流i 和I τ1/2 ;对不同电流密度条件下银电沉积过程的Iτ 1/2 ~i 作图,结果见图3 .由图可知,Iτ 1/2 与电流i 之间并非平行于电流坐标的直线,表明碱性DMH镀银体系中Ag的电沉积过程存在前置转化反应[22 , 23 ] . ...
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... , 22 ~24 ],形核过电位达到170 mV. ...
Electrodeposition behavior of zine in alkaline zincate electrolyte
5
2014
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 从图2 可以读取不同电流密度下银电沉积的过渡时间τ ,并根据玻碳电极面积 (S =0.071 cm2 ),计算得到电流i 和I τ1/2 ;对不同电流密度条件下银电沉积过程的Iτ 1/2 ~i 作图,结果见图3 .由图可知,Iτ 1/2 与电流i 之间并非平行于电流坐标的直线,表明碱性DMH镀银体系中Ag的电沉积过程存在前置转化反应[22 , 23 ] . ...
... 图7 为不同电位下碱性DMH体系中银电沉积的电化学阻抗谱.从图7a 可以看出,当施加电位为-0.70~-0.90 V时,交流阻抗谱高频区均表现为一个近似半圆的容抗弧,但随着过电位增大,容抗弧的曲率半径逐渐减小;而低频端呈现出一条倾斜角接近45°的直线,且电位越负、Warburg阻抗直线越明显.一般认为,高频容抗弧源于电荷转移及与电极表面的双电层电容,低频阻抗反映电沉积过程的速度控制步骤[23 , 26 ] .由此可知,碱性DMH镀银体系中银配离子[Ag(C5 H7 N2 O2 )]经历了放电过程;在-0.70~-0.80 V下,过电位较小,电极表面电结晶较慢,阴极放电过程受到电荷转移与扩散的混合控制;当过电位增大,阴极表面上提供成核的能量增加,形核更加容易,故而电沉积的电荷转移电阻也随之减小,-0.90 V下阴极反应也转为浓差极化控制. ...
... 然而,当施加电位降为-1.00 V时,电化学阻抗谱低频区发生了明显变化,出现了一个感抗弧,如图7b 所示;此表明电沉积过程中可能有中间产物吸附在电极表面[23 , 27 ] .分析认为此电位下,[Ag(C5 H7 N2 O2 )]经放电还原为Ag原子,但Ag原子无法持续进入晶格而造成其电极表面吸附;此外,高过电位下析氢反应加剧而产生大量气泡,加之Ag的沉积速度极快,电极表面的阴极电流分布极其不均匀也是造成此现象的重要原因. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
碱性锌酸盐体系中Zn的电沉积行为研究
5
2014
... 为了验证DMH镀银体系中银的电沉积过程是分步放电还是一步放电,是否经历前置转化反应,实验测定了不同电流密度下的计时电位曲线,见图2 .由图可知,银离子的电沉积还原过程非常短暂,50 s内电位即基本达到了平衡;且随着施加电流密度的增加,达到稳定电位所需的过渡时间 (τ) 越来越短,稳定电位平台也明显负移,对比可知电流密度为0.9 A/dm2 时计时电位曲线中的平台电位相比0.5 A/dm2 电流密度时增加了约41 mV,说明银离子的电化学还原过程中存在不可逆步骤,电流增大、银离子还原过程的可逆性不断减小[21 ] .根据Sand方程可知,当阴极放电反应没有前置转化步骤时,对I τ 1 / 2 i 作图,可以得到平行于电流坐标轴的直线[22 , 23 ] . ...
... 从图2 可以读取不同电流密度下银电沉积的过渡时间τ ,并根据玻碳电极面积 (S =0.071 cm2 ),计算得到电流i 和I τ1/2 ;对不同电流密度条件下银电沉积过程的Iτ 1/2 ~i 作图,结果见图3 .由图可知,Iτ 1/2 与电流i 之间并非平行于电流坐标的直线,表明碱性DMH镀银体系中Ag的电沉积过程存在前置转化反应[22 , 23 ] . ...
... 图7 为不同电位下碱性DMH体系中银电沉积的电化学阻抗谱.从图7a 可以看出,当施加电位为-0.70~-0.90 V时,交流阻抗谱高频区均表现为一个近似半圆的容抗弧,但随着过电位增大,容抗弧的曲率半径逐渐减小;而低频端呈现出一条倾斜角接近45°的直线,且电位越负、Warburg阻抗直线越明显.一般认为,高频容抗弧源于电荷转移及与电极表面的双电层电容,低频阻抗反映电沉积过程的速度控制步骤[23 , 26 ] .由此可知,碱性DMH镀银体系中银配离子[Ag(C5 H7 N2 O2 )]经历了放电过程;在-0.70~-0.80 V下,过电位较小,电极表面电结晶较慢,阴极放电过程受到电荷转移与扩散的混合控制;当过电位增大,阴极表面上提供成核的能量增加,形核更加容易,故而电沉积的电荷转移电阻也随之减小,-0.90 V下阴极反应也转为浓差极化控制. ...
... 然而,当施加电位降为-1.00 V时,电化学阻抗谱低频区发生了明显变化,出现了一个感抗弧,如图7b 所示;此表明电沉积过程中可能有中间产物吸附在电极表面[23 , 27 ] .分析认为此电位下,[Ag(C5 H7 N2 O2 )]经放电还原为Ag原子,但Ag原子无法持续进入晶格而造成其电极表面吸附;此外,高过电位下析氢反应加剧而产生大量气泡,加之Ag的沉积速度极快,电极表面的阴极电流分布极其不均匀也是造成此现象的重要原因. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
Effect of polyethylene glycol-600 on acidic Zn-Ni alloy electroplating and its corrosion resistance
2
2022
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... ~24 ],形核过电位达到170 mV. ...
聚乙二醇-600对酸性Zn-Ni合金的电沉积行为及镀层耐蚀性影响的研究
2
2022
... 图6 为不同扫描速率下DMH体系中银电沉积的循环伏安曲线.扫描速度为50 mV/s时,在0~-0.70 V,由于所施加的电势并未达到银离子的析出电位,电极表面几乎没有任何还原反应发生,电流几乎为零.电位达到-0.70 V后,电流密度急剧增大,电极表面开始出现Ag沉积,且在-1.05 V附近出现一个明显的阴极电流密度峰,对应的是银与DMH配合物[Ag(C5 H7 N2 O2 )]的还原反应[13 , 17 ~19 ] ;在-1.10~-1.15 V范围内,阴极过程同时包括银的电沉积和析氢反应,阴极电流随之呈现波动.换向正扫至-0.95 V附近,回扫电流高于阴极方向上的扫描电流并发生相交,出现了明显的“感抗性电流环”,此为形核过程的典型特征[1 ~4 , 18 , 19 , 22 ~24 ] ;当电位到达-0.78 V时,电流密度降为0;由此可知,碱性DMH体系中银的电沉积发生了电结晶过程,电极表面形成了稳定的核生长中心[13 , 15 , 22 ~24 ] ,形核过电位达到170 mV. ...
... ~24 ],形核过电位达到170 mV. ...
Nucleation and growth of copper on glassy carbon and steel
2
1994
... 此外,从图6 可以看出在不同的扫描速度下,循环曲线的阴极部分均只有一个还原峰,对应着银离子的还原过程;且随着扫描速度的增大,还原峰电位向负方向移动,所对应的还原峰电流密度增大,具体见表1 .由于可逆电极反应的峰值电位与扫描速率无关[19 , 21 , 25 ] ,故该现象表明碱性DMH镀银体系中银的电沉积过程为不可逆反应. ...
... 循环伏安曲线 (图6 ) 结果表明碱性DMH体系中银的电沉积经历了晶核形成的过程;而计时电流曲线能反映金属离子在阴极表面的电结晶成核和生长的重要信息.因此,本文测试了-0.87~-0.95 V的阶跃电位下,玻碳电极表面的银电沉积初期的电流密度-时间暂态曲线,结果见图8 ,由图可知,所有曲线均包括3个部分:由双电层充电引起电流密度迅速下降的过程,电流密度迅速增大直至达到峰值的经典成核过程以及电流密度迅速下降直到达到平衡的扩散控制过程.据此特征,可以判定在碱性DMH体系中银的电结晶属于三维形核[4 , 13 ~19 , 23 ~25 ] . ...
1
2002
... 图7 为不同电位下碱性DMH体系中银电沉积的电化学阻抗谱.从图7a 可以看出,当施加电位为-0.70~-0.90 V时,交流阻抗谱高频区均表现为一个近似半圆的容抗弧,但随着过电位增大,容抗弧的曲率半径逐渐减小;而低频端呈现出一条倾斜角接近45°的直线,且电位越负、Warburg阻抗直线越明显.一般认为,高频容抗弧源于电荷转移及与电极表面的双电层电容,低频阻抗反映电沉积过程的速度控制步骤[23 , 26 ] .由此可知,碱性DMH镀银体系中银配离子[Ag(C5 H7 N2 O2 )]经历了放电过程;在-0.70~-0.80 V下,过电位较小,电极表面电结晶较慢,阴极放电过程受到电荷转移与扩散的混合控制;当过电位增大,阴极表面上提供成核的能量增加,形核更加容易,故而电沉积的电荷转移电阻也随之减小,-0.90 V下阴极反应也转为浓差极化控制. ...
1
2002
... 图7 为不同电位下碱性DMH体系中银电沉积的电化学阻抗谱.从图7a 可以看出,当施加电位为-0.70~-0.90 V时,交流阻抗谱高频区均表现为一个近似半圆的容抗弧,但随着过电位增大,容抗弧的曲率半径逐渐减小;而低频端呈现出一条倾斜角接近45°的直线,且电位越负、Warburg阻抗直线越明显.一般认为,高频容抗弧源于电荷转移及与电极表面的双电层电容,低频阻抗反映电沉积过程的速度控制步骤[23 , 26 ] .由此可知,碱性DMH镀银体系中银配离子[Ag(C5 H7 N2 O2 )]经历了放电过程;在-0.70~-0.80 V下,过电位较小,电极表面电结晶较慢,阴极放电过程受到电荷转移与扩散的混合控制;当过电位增大,阴极表面上提供成核的能量增加,形核更加容易,故而电沉积的电荷转移电阻也随之减小,-0.90 V下阴极反应也转为浓差极化控制. ...
Mechanism of zinc electroplating in alkaline zincate solution
1
2007
... 然而,当施加电位降为-1.00 V时,电化学阻抗谱低频区发生了明显变化,出现了一个感抗弧,如图7b 所示;此表明电沉积过程中可能有中间产物吸附在电极表面[23 , 27 ] .分析认为此电位下,[Ag(C5 H7 N2 O2 )]经放电还原为Ag原子,但Ag原子无法持续进入晶格而造成其电极表面吸附;此外,高过电位下析氢反应加剧而产生大量气泡,加之Ag的沉积速度极快,电极表面的阴极电流分布极其不均匀也是造成此现象的重要原因. ...
Theoretical and experimental studies of multiple nucleation
1
1983
... 根据Scharifker三维多核生长模型[28 ] ,其瞬时成核和连续成核机理的无因次方程为: ...