电镀Zn-Ni合金的停镀过程,Zn阳极金属因长期浸泡在酸性镀液中溶解过快这一问题未得到有效解决。停镀过程中Zn阳极金属的持续溶解主要有两个弊端,一是金属不断溶解会导致镀液中金属离子的浓度比例失衡,而Zn-Ni镀液中Zn2+/Ni2+的比值对电沉积所得Zn-Ni合金镀层的耐蚀性有重要影响,研究表明[1],当镀液中Ni2+/Zn2+比值控制在0.5~1.5范围时,合金镀层中Ni含量升高显著提高了镀层的耐蚀性。此外,停镀过程中Zn阳极持续溶解反而增加了生产成本。研究表明,对于表面活性剂、络合剂、光亮剂等电镀添加剂的研究主要集中在提高合金镀层耐蚀性和改善镀层表面性能等方面[2,3],而电镀添加剂对控制阳极溶解速度的影响少见报道。研究酸性Zn-Ni镀液中添加剂对Zn阳极溶解行为的影响对保证镀液长期稳定有重要的工程意义。
苯甲酸钠 (SB) 作为一种有机表面活性剂,因无毒、经济成本低、对环境友好等一系列优点被广泛应用于金属和合金的缓蚀剂[4]。研究表明SB及其复配物在不同腐蚀介质中对多种金属均有良好缓蚀效果。李凌杰等[5]认为在3.5% (质量分数) NaCl中SB浓度在一定范围内增加时AZ31镁合金缓蚀率逐渐增大,吸附过程满足TemKin等温吸附式。赵阳等[6]研究发现SB对AM60镁合金具有良好缓蚀效果,热力学参数表明吸附过程属于物理吸附控制的放热、熵增过程。研究[7,8]认为当几种缓蚀剂进行复配时对多种金属和合金表现出良好协同缓蚀作用,且复配型缓蚀剂在金属表面满足Langmuir等温吸附式。Mohammed等[9]认为腐蚀介质中缓蚀剂浓度增加使缓蚀率增大会导致低碳钢腐蚀反应的活化能降低。目前,基于SB缓蚀剂对金属缓蚀效果的研究,其腐蚀介质主要为人工模拟的含Cl-、S2-等侵入型离子溶液,本实验在配制的酸性氯化物Zn-Ni镀液中不通电的条件 (等效于停镀过程),采用动电位极化曲线和电化学阻抗谱研究了SB浓度对Zn阳极溶解行为及缓蚀率的影响,通过静态腐蚀失重分析方法探究了酸性Zn-Ni镀液中添加不同浓度SB后温度条件对Zn阳极缓蚀率的影响,分别采用Freundlich和Langmuir等温吸附式对SB在Zn表面的吸附模式进行了拟合,探究了该缓蚀体系中SB在Zn表面的吸附模型,研究了不同温度条件时SB在Zn表面吸附的热力学参数变化,观察了Zn-Ni镀液中未添加与添加SB时Zn腐蚀后的表面形貌。
1 实验方法
本实验将配制的酸性Zn-Ni镀液 (AZNB溶液) 作为基础电解质溶液体系。其配制过程为:于1L烧杯容器中加入500 mL蒸馏水,采用水浴加热装置将其加热至45 ℃后加入20 g H3BO4搅拌均匀,再依次加入45 g ZnCl2、85 g NiCl2·6H2O、125 g KCl,充分搅拌使其混合均匀,再于1L烧杯中补加500 mL蒸馏水,搅拌均匀后用HCl将pH调至5.4即可得到本实验的电解质溶液。缓蚀剂为苯甲酸钠 (SB),配制过程所采用的实验药品及缓蚀剂均为分析纯。为了研究缓蚀剂SB对Zn阳极的缓蚀效果,分别在酸性Zn-Ni镀液中添加不同浓度的SB作为电解质溶液缓蚀体系。
在进行电化学测试和静态腐蚀失重实验前,将10块尺寸为1 cm×1 cm×1.2 cm的Zn块 (其化学成分 (质量分数,%) 为:Al 0.001,Cu 0.001,Fe 0.001,Pb 0.003,Cd 0.002,Sn 0.001,余Zn) 依次用800#、1000#、1500#砂纸逐级打磨至表面光滑,用蒸馏水清洗表面,再用除油液 (25 g/L NaOH,35 g/L Na3PO4·12H2O,32 g/L Na2CO3) 除去Zn表面的油脂,室温除油2 min即可,蒸馏水再次清洗Zn块表面后干燥。为了方便研究,本实验将10块Zn块分为两批,其中5块作为电化学测试所用的工作电极,分别在5块Zn块的一端表面用导电胶固定一根长度为5 cm的铜导线,再采用冷镶的方法用环氧树脂将其封装;另5块Zn块用以静态腐蚀失重测试,不进行封装处理。
室温条件下,采用CH1660电化学工作站。进行Zn的动电位极化曲线和电化学阻抗谱测试,采用的电解质溶液分别为未添加SB和添加不同浓度SB的酸性Zn-Ni镀液。将已经冷镶封装好的Zn块作为工作电极,工作电极在电解质溶液中的裸露面积为1 cm2,辅助电极为Pt电极,参比电极为饱和甘汞电极。电化学阻抗谱测试在Zn工作电极的开路电位下进行,交流信号振动幅值为0.005 V,扫描频率范围为105
将Zn块置入不同的电解质溶液之前,先对其进行编号、称重并记录。在不同温度条件下将已经打磨处理好的5块Zn块分别放置于未添加SB和添加不同含量SB的酸性Zn-Ni镀液中,每个温度条件在恒温保温箱中放置168 h后取出,用蒸馏水清洗Zn表面,干燥后称重。为了减小误差,静态腐蚀失重实验设置两组平行样,每组样品腐蚀前后各进行3次称重,并取其平均值作为失重测试结果。
室温条件下将Zn块分别放置于添加和未添加SB的酸性Zn-Ni镀液中腐蚀48 h后取出,用蒸馏水清洗表面后干燥。再采用Nova Nano SEM450场发射扫描电子显微镜 (SEM) 分别对两种不同腐蚀介质中腐蚀后的Zn块表面进行微观形貌观察。
2 结果与分析
2.1 动电位极化分析
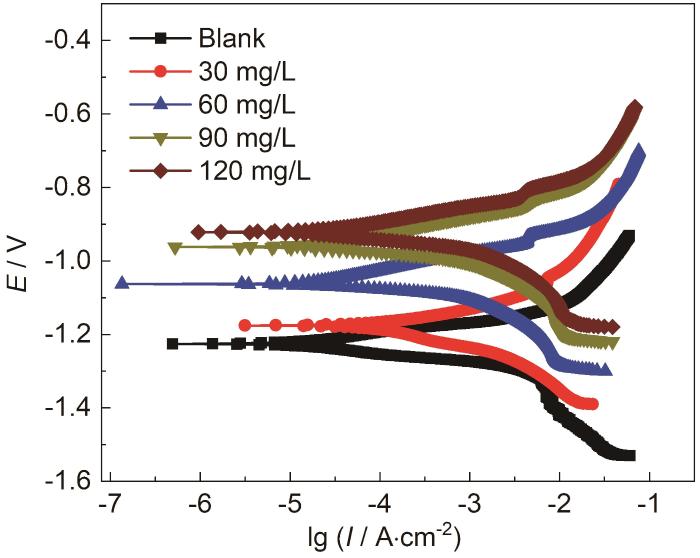
图1
图1
酸性Zn-Ni镀液中含不同浓度SB时Zn的极化曲线
Fig.1
Polarization curves of Zn in acidic Zn-Ni plating baths containing different concentrations of SB
表1 酸性Zn-Ni镀液中含不同浓度SB时Zn极化曲线的拟合参数
Table 1
| Content mg·L-1 | EcorrV | IcorrA·cm-2 | βaV·dec-1 | -βcV·dec-1 | ηi % |
|---|---|---|---|---|---|
| 0 | -1.22 | 13.80×10-5 | 8.61 | 6.96 | --- |
| 30 | -1.17 | 5.38×10-5 | 13.24 | 10.67 | 60.98 |
| 60 | -1.04 | 4.24×10-5 | 8.97 | 7.80 | 69.31 |
| 90 | -0.96 | 3.28×10-5 | 8.68 | 7.82 | 76.29 |
| 120 | -0.92 | 2.73×10-5 | 9.98 | 8.34 | 80.24 |
式中,I0corr和Icorr分别为不含SB和含不同浓度SB时Zn的自腐蚀电流密度。由表可知,AZNB中随SB浓度的增加,Zn的自腐蚀电流密度逐渐减小。AZNB中含不同浓度SB时,阳极极化率均大于阴极极化率,表明该缓蚀体系中SB属于阳极型缓蚀剂。此外,当AZNB中含不同浓度SB时,Zn的缓蚀率大小依次为:ηi (120 mg/L)>ηi (90 mg/L)>ηi (60 mg/L)>ηi (30 mg/L)。由此可知,AZNB中随SB浓度增加,对Zn的缓蚀效率越高,当SB浓度为120 mg/L时,Zn的自腐蚀电流密度最低,其缓蚀率最高为80.24%,表明AZNB中添加SB对Zn的腐蚀反应起到抑制效果。
2.2 电化学阻抗谱分析
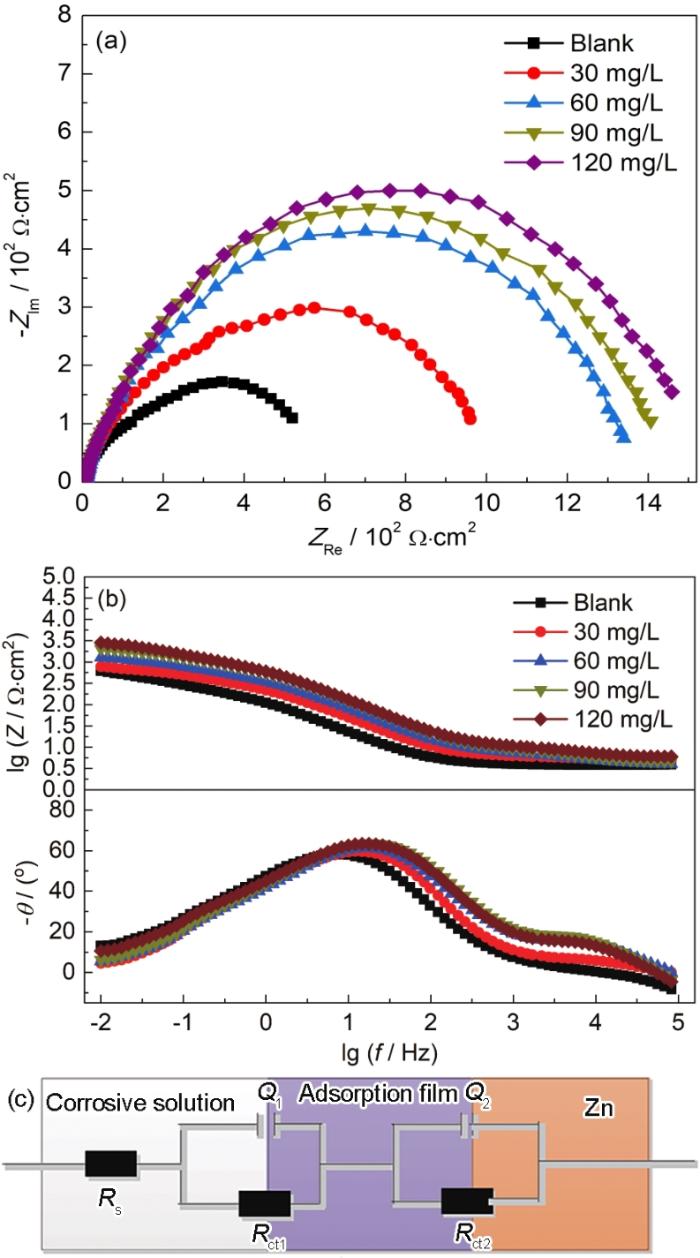
图2为AZNB中含不同浓度SB时Zn的电化学阻抗谱。由图2a可见,AZNB中不含SB和含不同浓度的SB时,Zn的电化学阻抗谱均为一个单一的容抗弧,表明AZNB中添加SB后Zn的电化学腐蚀机理未发生改变。随SB浓度增加,容抗弧的直径逐渐增大,由图2b可见,随AZNB中SB浓度的增加,阻抗模值逐渐增大,表明Zn的腐蚀反应过程更难进行。因为该电化学体系中在电极与电解质溶液的界面处,SB分子在Zn表面会形成吸附膜,结合Nyquist图和Bode相位角图可知,阻抗谱低频区域未出现Warburg阻抗弧,相位角-频率图中低频区域也未出现45
图2
图2
酸性Zn-Ni镀液中含不同浓度SB时Zn的电化学阻抗谱及等效电路
Fig.2
Nyquist (a) and Bode (b) diagrams of Zn in acidic Zn-Ni plating baths containing different concentrat-ions of SB and equivalent circuit of EIS (c)
表2 酸性Zn-Ni镀液中含不同浓度SB时电化学阻抗等效电路拟合参数
Table 2
| Content / mg·L-1 | Rs / Ω·cm2 | Q1 / 10-4S·s-n ·cm-2 | Qn-1 | Rct1 / 102 Ω·cm2 | Q2 / 10-4S·s-n ·cm-2 | Qn-2 | Rct2 / 102 Ω·cm2 | ηR / % |
|---|---|---|---|---|---|---|---|---|
| 0 | 3.84 | 20.68 | 0.80 | 1.59 | 7.14 | 0.79 | 4.28 | --- |
| 30 | 7.54 | 7.29 | 0.98 | 1.14 | 1.16 | 0.71 | 9.15 | 42.95 |
| 60 | 5.18 | 4.72 | 0.75 | 2.35 | 1.05 | 0.83 | 11.25 | 56.84 |
| 90 | 5.15 | 5.02 | 0.74 | 2.97 | 1.05 | 0.85 | 11.09 | 58.25 |
| 120 | 3.82 | 6.19 | 0.73 | 3.53 | 1.84 | 0.87 | 11.83 | 61.78 |
式中,Rp0为不含SB时缓蚀体系的极化电阻值,Rp为含不同浓度SB时缓蚀体系的极化电阻值。由表2可知,AZNB中添加SB后各缓蚀体系的极化电阻值均大于未添加SB时的极化电阻,且AZNB中随SB浓度增加,Rct2呈总体增大的趋势,而Rct2的大小可以衡量AZNB中腐蚀介质渗透至吸附膜层后与Zn界面发生腐蚀反应的难易程度,这表明AZNB中SB浓度在一定范围增加时Zn的溶解反应更难进行。AZNB中SB浓度在0
2.3 静态腐蚀失重分析
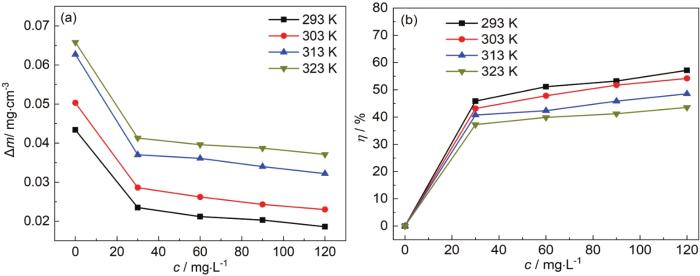
图3
图3
不同温度和浓度条件下Zn在酸性Zn-Ni镀液中的失重曲线及Zn的缓蚀率变化曲线
Fig.3
Mass loss (a) and corrosion inhibition rate (b) curves of Zn in acidic Zn-Ni plating bath under different conditions of temperature and SB concentration
2.4 表面形貌分析
图4为Zn在AZNB中未添加和添加SB浸泡24 h后的表面形貌图。从图可见,未添加SB时Zn表面腐蚀明显,呈粗糙和凹凸不平的微观形貌。而AZNB中添加SB后Zn表面只出现少量点蚀,但整体表面仍较平整,可见Zn前处理时的打磨划痕。这表明添加SB后Zn的腐蚀程度显著降低,SB在AZNB中可有效抑制Zn的腐蚀。
图4
图4
在未添加和添加SB的酸性Zn-Ni镀液中Zn的表面形貌
Fig.4
Surface morphologies of Zn in acidic Zn-Ni plating baths without (a) and with (b) SB
2.5 SB在Zn表面的等温吸附式
为了研究AZNB中SB对Zn腐蚀反应的影响,采用等温吸附曲线研究SB分子在Zn表面的吸附行为。为了方便研究,缓蚀剂分子在金属表面的覆盖率 (θ) 用缓蚀率 (ηi /ηR) 代替。在水溶液中缓蚀剂分子与金属表面水分子之间的吸附过程表示见
式中,Org(sol) 为水溶液中的有机分子,Org(ads) 为吸附在金属表面的有机分子,H2O(ads) 为金属表面的水分子,X为有机吸附剂取代水分子数量的大小比。
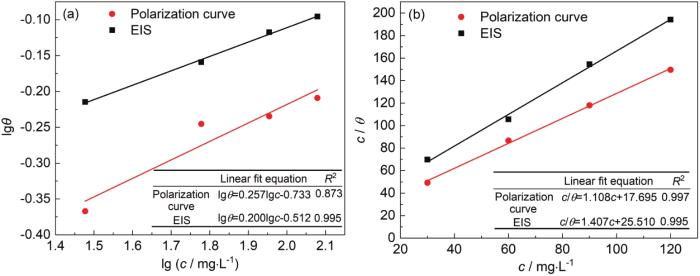
图5
图5
苯甲酸钠在Zn表面两种不同模型的等温吸附线
Fig.5
Adsorption isotherms of SB on Zn surface: (a) fre-undlich adsorption model, (b) Langmuir adsorp-tion model
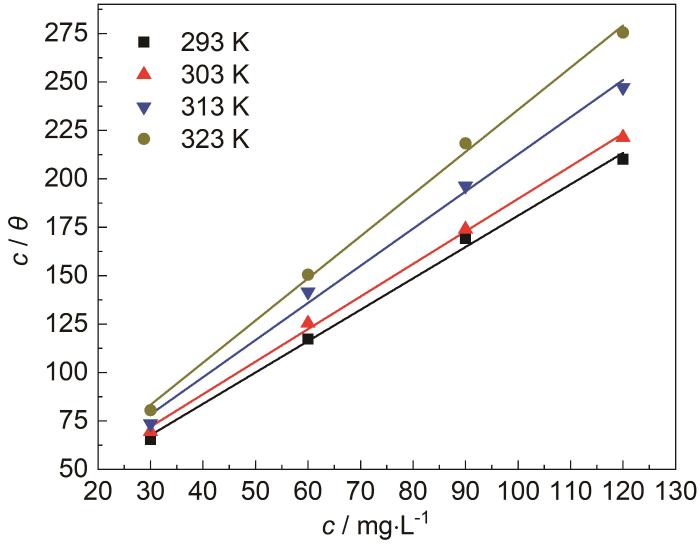
2.6 温度对SB在Zn表面吸附行为的影响
图6
图6
不同温度条件下SB在Zn表面的等温吸附曲线
Fig.6
Adsorption isotherms of SB on Zn surface under different temperature conditions
表3 不同温度下等温吸附曲线的拟合结果
Table 3
| TemperatureK | f | f /KL | KL | Linear fit equation | Correlation coefficient R2 |
|---|---|---|---|---|---|
| 293 | 1.618 | 19.075 | 0.084 | c/θ=1.618c+19.075 | 0.995 |
| 303 | 1.680 | 21.535 | 0.078 | c/θ=1.680c+21.535 | 0.997 |
| 313 | 1.823 | 24.713 | 0.073 | c/θ=1.823c+24.713 | 0.992 |
| 323 | 2.005 | 29.778 | 0.067 | c/θ=2.005c+29.778 | 0.996 |
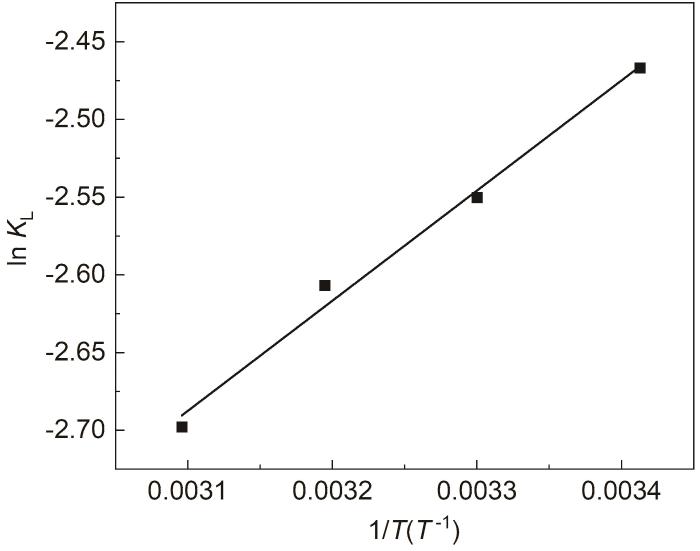
2.7 SB在Zn表面吸附的热力学参数变化
在293
图7
图7
SB在Zn表面吸附的lnKL/T -1的关系曲线
Fig.7
lnKL/T -1 curve for adsorption of SB on Zn surface
对于SB在Zn表面的吸附过程,
式中,KL为Langmuir吸附平衡常数,
表4 不同温度条件时SB在Zn表面的热力学函数参数
Table 4
| Temperature / K | ΔH0 / kJ·mol-1 | ΔG0 / kJ·mol-1 | ΔS0/ J/ mol·k |
|---|---|---|---|
| 293 | -6.289 | -27.644 | 72.883 |
| 303 | -6.289 | -28.378 | 72.901 |
| 313 | -6.289 | -29.167 | 73.091 |
| 323 | -6.289 | -29.855 | 72.958 |
3 讨论
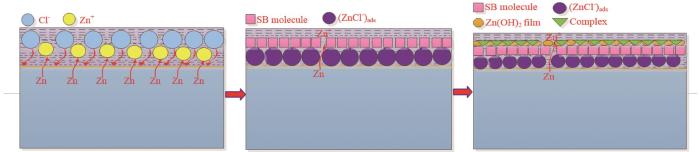
静态腐蚀失重实验观察到Zn阳极表面持续产生气泡 (H2),结合腐蚀反应式 (11) 可知,Zn阳极在酸性Zn-Ni镀液中发生的腐蚀溶解反应类型主要为析氢腐蚀。停镀过程Zn阳极浸泡在酸性Zn-Ni镀液中时其腐蚀反应过程较复杂,据已有文献可知其阳极和阴极反应机理及过程见式 (
图8
图8
Zn的腐蚀溶解过程及缓蚀剂SB分子吸附的模型图
Fig.8
Model diagrams of the corrosion dissolution process of Zn and the adsorption of SB molecules as corrosion inhibitor
由动电位极化曲线和电化学阻抗谱分析结果可知,酸性Zn-Ni镀液中随SB浓度增加,其缓蚀率逐渐增大最后趋于平缓,这是因为缓蚀剂SB分子对Zn的缓蚀效果与其在金属表面的吸附行为有关,当SB浓度达到一定值时,SB在Zn表面吸附将趋于饱和状态[23]。由静态腐蚀失重结果可知,SB浓度相同时温度升高导致SB对Zn的缓蚀率降低,因为温度升高时分子快速运动加剧了Zn在AZNB中的析氢腐蚀,腐蚀反应逸出的H2会使SB分子在Zn表面形成的吸附膜脱落,从而导致其缓蚀效率降低[13]。由等温吸附曲线结果可知,SB分子在Zn表面的吸附模式属于Langmuir吸附模型,温度升高时SB分子在Zn表面的KL逐渐减小,导致SB分子在Zn表面的吸附能力降低。由于SB在Zn表面的吸附焓
4 结论
(1) 停镀过程AZNB中添加SB后对Zn阳极的溶解反应具有良好抑制作用,SB浓度在30
(2) SB缓蚀剂分子在Zn表面的吸附满足Langmuir等温吸附模型。温度升高时SB缓蚀剂分子在Zn表面的吸附平衡常数KL值逐渐减小,SB分子在Zn表面的吸附能力降低,导致SB对Zn的缓蚀率降低。
(3) 在293~323 K的温度范围内,ΔH0<0、ΔG0值介于-29.855~-27.644 kJ·mol-1之间且ΔS0>0,表明SB缓蚀剂分子在Zn表面是由物理吸附和化学吸附混合控制自发进行的熵增过程。
参考文献
Effect of Ni/Zn ratio in plating solution on Zn-Ni electroplating of acidic liquid
[J].
镀液中镍锌含量比对酸性液电镀Zn-Ni合金的影响
[J].
Research status and prospect of Zn-Ni alloy electroplating
[J].
电镀锌镍合金的研究现状与展望
[J].
Effect of operating conditions on Ni content of Zn-Ni alloy deposit in acidic solution
[J].
酸性液电镀Zn-Ni合金的操作条件对镀层中Ni含量的影响
[J].
Electrochemical properties and corrosion inhibition of AA6061 in tropical seawater
[J].
Corrosion inhibition of AZ31 magnesium alloy by sodium benzoate
[J].
苯甲酸钠对AZ31镁合金的缓蚀作用
[J].
Corrosion inhibition of sodium benzoate for AM60 magnesium alloys in 3.5%NaCl solution
[J].
苯甲酸钠对AM60镁合金在氯化钠溶液中的缓蚀作用
[J].
Corrosion behaviour of metal in antifreeze fluid containing sodium benzoate and benzotriazole
[J]. J.
防冻液中苯并三氮唑与苯甲酸钠对多种金属的缓蚀作用
[J].
Synergistic inhibition effect of trisodium phosphate and sodium benzoate with sodium dodecyl benzene sulphonate on the corrosion of Mg-Al-Zn-Mn alloy in 30% ethylene glycol containing chloride ions
[J].The enhanced efficiency of the sodium dodecyl benzene sulphonate (SDBS) by the addition of trisodium phosphate and sodium benzoate on the corrosion inhibition of Mg-Al-Zn-Mn alloy in aqueous ethylene glycol solution (30%) containing chloride ions was studied by potentiodynamic polarization technique and electrochemical impedance spectroscopy method. The combination of SDBS with trisodium phosphate and sodium benzoate resulted in synergistic effects on the inhibition efficiency. The inhibition efficiencies decreased with the increase in the medium temperature. The mixture of inhibitors acted predominantly as anodic types and the adsorption of the inhibitors on the surface of the alloy obeyed Langmuir adsorption isotherm.
The effect of sodium benzoate and sodium 4-(phenylamino) benzenesulfonate on the corrosion behavior of low carbon steel
[J].
Inhibition for Zn corrosion by starch grafted copolymer
[J]. J.
淀粉接枝共聚物对Zn的缓蚀性能
[J].
Gray correlative degree analysis of Q235 steel/conductive concrete corrosion in three typical soil environments
[J]. J.
Q235钢/导电混凝土在3种典型土壤环境中腐蚀的灰色关联度分析
[J].
The corrosion inhibition effect of sodium dodecylbenzene sulfonate on AZ31B magnesium alloy
[J].
十二烷基苯磺酸钠对AZ31B镁合金的缓释效果研究
[J].
Adsorption and inhibition behavior of imidazoline on steel surface in trichloroacetic acid solution
[J]. J.
三氯乙酸溶液中咪唑啉在钢表面的吸附及缓蚀行为
[J].
Inhibitive effect of sodium (E)-4-(4-nitrobenzylideneamino) benzoate on the corrosion of some metals in sodium chloride solution
[J].
L-proline mixed with sodium benzoate as sustainable inhibitor for mild steel corrosion in 1M HCl: an experimental and theoretical approach
[J].
Study on adsorption thermodynamics and corrosion inhibition of sodium dodecylbenzene sulfonate on zinc in nitric acid
[J].
硝酸溶液中十二烷基苯磺酸钠对锌的缓蚀作用及吸附热力学研究
[J].
On the inhibition of mild steel corrosion by 4-amino-5-phenyl-4H-1, 2, 4-trizole-3-thiol
[J].
Sodium dodecyl benzene sulfonate as a sustainable inhibitor for zinc corrosion in 26%NH4Cl solution
[J].
Inhibitory action of aqueous garlic peel extract on the corrosion of carbon steel in HCl solution
[J].
Corrosion behavior of mild steel in acetic acid solutions
[J].
Investigation of the mechanism for acetic acid corrosion of mild steel
[A].
Synergistic inhibition of zinc corrosion by benzotriazole in combination with sodium phosphate
[J]. J.
苯并三氮唑和磷酸钠对锌的协同缓蚀
[J].