淀粉是资源十分丰富的天然高分子化合物,但作为缓蚀剂直接使用时存在缓蚀性能较差、易老化、糊化、水溶性差、易增稠等局限性,严重制约了淀粉在缓蚀剂工业领域中的应用。为此,本课题组[9,10]近年来一直专注于采用烯类单体对淀粉进行接枝共聚改性制备出缓蚀性能优良的淀粉接枝共聚物,曾报道过丙烯酰胺 (AA) 接枝到木薯淀粉 (CS) 上的二元接枝共聚物对冷轧钢在酸溶液中缓蚀性能可大幅度提升,并解释为丙烯酰胺接枝到淀粉碳链后增强了与金属表面的吸附强度。为了更进一步增加吸附活性点,本文将烯丙基磺酸钠 (SAS) 和丙烯酰胺同时接枝到木薯淀粉上制备得到木薯淀粉三元接枝共聚物,采用红外光谱 (FTIR) 进行结构表征,并通过失重法和电化学法测试研究了CS-SAS-AAGC对冷轧钢在H2SO4溶液中的缓蚀性能,深入揭示缓蚀剂浓度、温度、酸浓度和腐蚀浸泡时间对缓蚀性能的影响规律,并对钢表面采用SEM和接触角测试深入研究其微观形貌和亲水/疏水性质,以便进一步探究淀粉接枝共聚物的缓蚀行为及作用机理。
1 实验方法
原料CS为市售;丙烯酰胺 (CH2=CHCONH2)、烯丙基磺酸钠 (C3H5SO3Na)、(NH4)2S2O8、NaHSO3、H2SO4 (98%)、无水C2H5OH、丙酮均为分析纯。冷轧钢片试样的成分 (质量分数,%) 为:C 0.07,Si 0.01,Mn 0.3,P 0.022,S 0.01,Al 0.030,Fe余量。
将3 g的CS置于三口烧瓶中加入150 mL H2O,水浴至80 ℃后通N2持续搅拌0.5 h后静置冷却至55 ℃时加入0.3 g (NH4)2S2O8和0.35 g NaHSO3作为引发剂搅拌10 min,然后同时加入6.0 g SAS和12.0 g AA,保持在55 ℃持续搅拌约3.5 h,待反应体系冷却至室温 (22~25 ℃) 后加入350 mL无水C2H5OH后静置得到白色沉淀,过滤、真空干燥可得接枝粗产物,最后用丙酮作为溶剂对粗产物进行索氏提取可得到精制的CS-SAS-AAGC。
采用AVATAR-FTIR-360红外光谱仪 (FTIR) 进行分析测试,最小分辨率是1 cm-1,采用KBr压片法,测量范围为400~4000 cm-1。
用砂纸将25.0 mm×20.0 mm×0.6 mm的冷轧钢片试样进行逐级打磨光亮、丙酮脱脂储存于真空干燥器中备用。将表面处理好的钢片试样精确称取初始质量 (±0.1 mg) 后,用玻璃钩全浸于250 mL未添加或添加有缓蚀剂的H2SO4溶液中。恒温水浴一定时间后取出钢片,洗净、吹干后称取钢片在试液浸泡后的质量。腐蚀速率 (v) 和缓蚀率 (ηw) 可按下式进行换算:
式中,W为钢片在H2SO4溶液中浸泡前后的质量差,g;S为钢片的表面积,m2;t为腐蚀浸泡时间,h。
式中,v0和v为钢片在未添加和添加缓蚀剂的H2SO4溶液中浸泡前后的腐蚀速率,g·m-2·h-1。
电化学测试在PARSTAT2273电化学工作站上进行,采用传统三电极体系:参比电极为套有Luggin毛细管的饱和KCl甘汞电极 (SCE),对电极为Pt电极,工作电极的裸露面积为1.0 cm×1.0 cm,其余部分由环氧树脂灌封。测试前,将工作电极在250 mL H2SO4测试液中浸泡2 h以使开路电位充分稳定。动电位极化曲线的扫描范围为-250~+250 mV (相对于开路电位),扫描速率为0.5 mV/s,极化曲线法测得的缓蚀率 (ηp) 由下式进行求算:
式中,Icorr(0)和Icorr(inh)为钢片在未添加和添加缓蚀剂的H2SO4溶液中的腐蚀电流密度,μA/cm2。
电化学阻抗谱 (EIS) 的测量频率为105~10-2 Hz,交流激励幅值为10 mV,数据采集点为30,据下式计算缓蚀率 (ηR):
式中,Rt(0)和Rt(inh) 为钢片在未添加和添加缓蚀剂的H2SO4溶液中的电荷转移电阻,Ω·cm2。
采用FEI QUANTA 200型扫描电镜 (SEM) 观察微观形貌,测试前对钢表面进行50 nm厚度的喷金处理,检测器为二次电子Everhart-Thornley检测器,加速电压为20 kV,工作距离为6.6 mm。接触角测试为Dataphyscis OCA20视频光学接触角测量仪,测试时在钢表面滴加2 μL的蒸馏水滴。
2 结果与讨论
2.1 CS和CS-CS-SAS-AAGC的FTIR分析
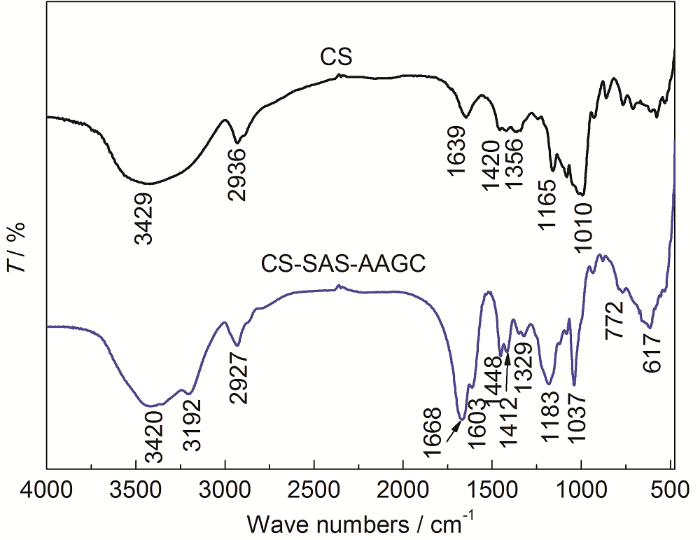
图1为CS和CS-CS-SAS-AAGC的FTIR谱图。由CS的FTIR谱可看出,在3429 cm-1处的宽吸收峰为O—H伸缩振动吸收峰,2936 cm-1可归属为—CH2中C—H键的伸缩振动。1639 cm-1处的吸收峰可能是由于木薯淀粉中的残留水份[11]。1420 cm-1为—CH2的弯曲振动吸收或者为C—O—O伸缩振动,1356 cm-1的吸收峰可归属为—CH2的变形振动峰。1165和1010 cm-1的吸收峰分别为 C—O (或C—C) 伸缩振动和C—O—H的弯曲振动。由CS-CS-SAS-AAGC的红外光谱可以看出,3447和3192 cm-1的两个吸收峰分别为O—H和N—H的伸缩振动;C—H的伸缩振动峰位置为2927 cm-1,1668 cm-1处的强吸收峰为酰胺 (—CONH2) 中的C=O伸缩振动,1603 cm-1处的肩峰为C=C的伸缩振动。官能团—CH2的弯曲振动C—O—O伸缩振动分别在1451和1417 cm-1产生吸收峰。1329 cm-1出的吸收峰为C—O—H的弯曲振动。值得注意的是,在1183 cm-1处有一个相对强的吸收带,可能为磺酸基 (—SO3H) 中S=O的伸缩振动。1037 cm-1为C—O,C—N或C—C的伸缩振动吸收峰。对比分析CS-SAS-AAGC和CS具有一些类似的官能团,但也新增了S=O,N—H和C=C官能团,表面可通过两种烯类单体SAS和AA接枝共聚在CS上成功制备出CS-SAS-AAGC。
图1
2.2 失重法测试CS-SAS-AAGC对CRS的缓蚀性能
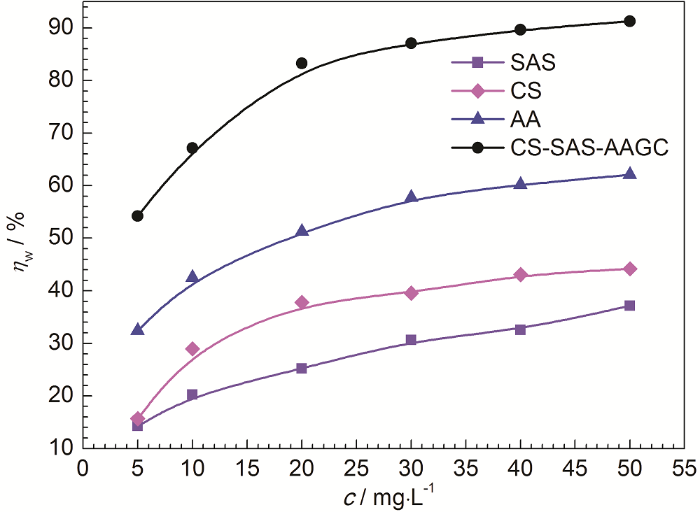
图2为25 ℃时1.0 mol/L H2SO4溶液中的各化合物对CRS的缓蚀率 (ηw) 随缓蚀剂浓度 (c,mg/L) 的变化曲线 (腐蚀浸泡时间为6 h)。
图2
图2
20 ℃时1.0 mol/L H2SO4溶液中CS-SAS-AAGC的缓蚀率与缓蚀剂浓度的关系
Fig.2
Relations between inhibition efficiency of CS-SAS-AAGC and inhibitor mass fraction in 1.0 mol/L H2SO4 solution at 20 ℃
从图2中可以看出,各化合物的ηw均随缓蚀剂浓度用量的增加而不断升高,添加量为50 mg/L时,SAS、CS、AA、CS-SAS-AAGC的缓蚀率分别为37.2%、44.2%、62.1%和91.3%,表明原材料CS和烯类单体SAS的缓蚀性能较差,烯类单体AA具有中等程度的缓蚀作用,而接枝共聚改性后的产物CS-SAS-AAGC则缓蚀性能大幅度提升,具有良好的缓蚀性能。
课题组前期研究[10]表明,将AA接枝在CS上生成的木薯淀粉二元接枝共聚物CSGC亦对冷轧钢在1.0 mol/L H2SO4溶液中具有良好的缓蚀性能,失重法测试得出20 ℃时添加浓度为50 mg/L时的缓蚀率为89.6%。因此,将两种单体同时接枝在木薯淀粉制备的三元接枝共聚物的缓蚀性能优于二元接枝共聚物。
2.3 CS-SAS-AAGC在CRS表面的吸附行为
式中,K为吸附平衡常数,L/mg。
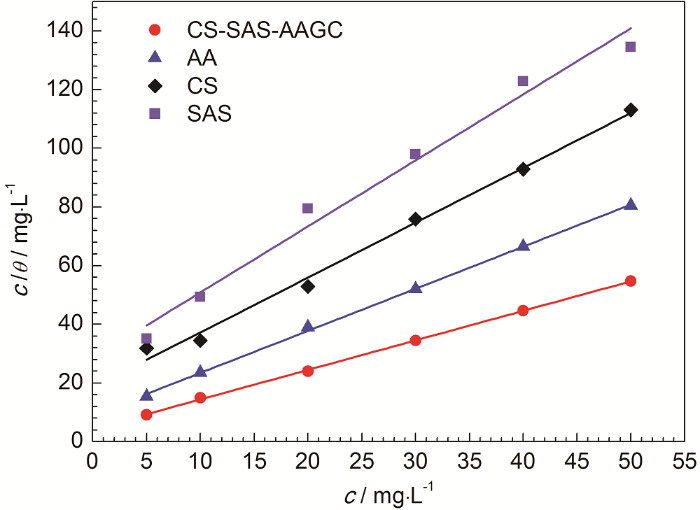
图3
图3
20 ℃时1.0 mol/L H2SO4溶液中的c/θ-c直线
Fig.3
Straight lines of c/θ-c in 1.0 mol/L H2SO4 at solution 20 ℃
表1 c/θ-c直线回归参数及标准吸附Gibbs自由能
Table 1
| Inhibitor | r 2 | Slope | K / L·mg-1 | ΔG0 / kJ·mol-1 |
|---|---|---|---|---|
| SAS | 0.9799 | 2.25 | 0.03528 | -25.5 |
| CS | 0.9917 | 1.87 | 0.05403 | -26.6 |
| AA | 0.9990 | 1.44 | 0.1103 | -28.3 |
| CS-SAS-AAGC | 0.9996 | 1.01 | 0.2320 | -30.1 |
缓蚀剂分子在金属表面的吸附为驱替已在金属表面吸附的水分子的作用过程,故吸附平衡常数 (K) 与标准吸附自由能 (ΔG0) 存在如下关系式[13]:
式中,ρsolvent为缓蚀体系中溶剂H2O的质量浓度,约为1.0×106 mg/L;T为温度,K;R为理想气体常数,8.314 J·mol-1·k-1。
2.4 温度对CS-SAS-AAGC的缓蚀性能影响
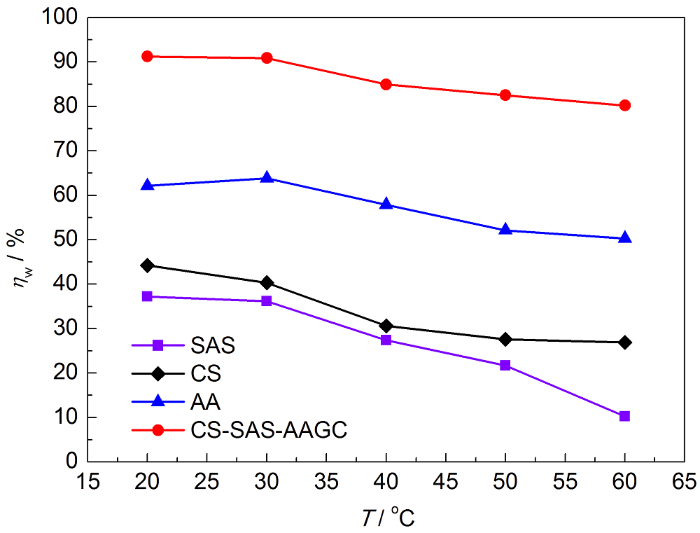
固定缓蚀剂浓度为50 mg/L,浸泡时间为6 h,采用失重法测试了20~60 ℃在1.0 mol/L H2SO4溶液中的缓蚀率,结果见图4。可以看出,ηw随温度的升高而逐渐下降,当温度升高至60 ℃时,SAS、CS、AA、CS-SAS-AAGC的缓蚀率分别下降至10.3%、26.9%、50.3%和80.2%,这是由于高温时H2SO4溶液对钢表面的腐蚀程度急剧增加,实验中可观察到钢表面析出H2的速率显著加剧,不仅会使已吸附在钢表面的缓蚀剂分子发生脱附,且溶液相中的缓蚀剂分子也难以在钢表面发生吸附。
图4
图4
1.0 mol/L H2SO4溶液中的缓蚀率与温度的关系
Fig.4
Relations between inhibition efficiency and tempera-ture in1.0 mol/L H2SO4 solution
根据Arrhenius公式,v随温度的变化存在如下定量关系式[15]:
式中,Ea为表观活化能,A为指前因子。
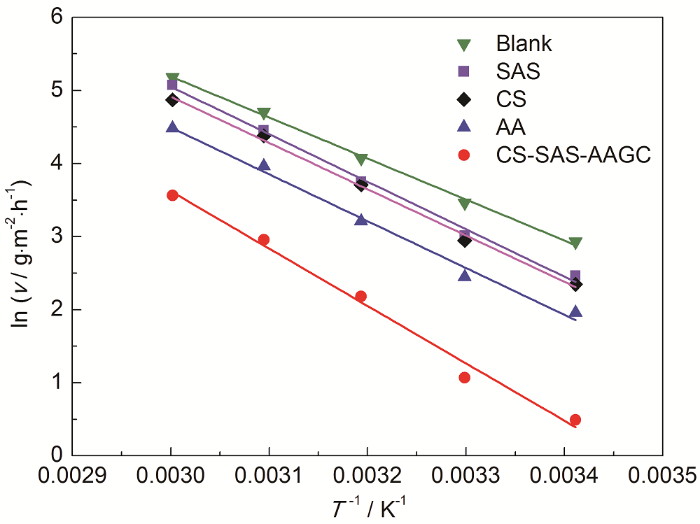
作lnv-1/T拟合直线,见图5,并由直线的斜率和截距可分别求出Ea和A,结果列于表2中。从表2中看出,在H2SO4溶液介质中添加SAS、CS、AA、CS-SAS-AAGC后,和空白未添加缓蚀剂的溶液相比,Ea和A均有所上升。根据 (7) 式可知,欲使腐蚀速率趋于较低值 (较高的缓蚀性能),需使Ea具有较大值,而A具有较小值,另外Ea值的大小代表了腐蚀速率随温度的变化幅度。因此,本体系中添加SAS、CS、AA、CS-SAS-AAGC后腐蚀速率的下降主要是归因于Ea的上升,接枝共聚产物CS-SAS-AAGC的Ea值明显高于合成所用原材料CS和烯类单体SAS、AA,表明CS-SAS-AAGC中的缓蚀作用随温度升高而下降的幅度较大。
图5
图5
1.0 mol/L H2SO4溶液中ln v-1/T拟合直线
Fig.5
Fitted lines of ln v-1/T in1.0 mol/L H2SO4 solution
表 2 lnv-1/T直线的腐蚀动力学参数
Table 2
| Inhibitor | r 2 | Ea / kJ·mol-1 | A / g·m-2·h-1 |
|---|---|---|---|
| Blank | 0.9970 | 46.65 | 3.68×109 |
| SAS | 0.9941 | 54.04 | 4.61×109 |
| CS | 0.9961 | 52.67 | 2.44×1010 |
| AA | 0.9864 | 53.29 | 2.01×1010 |
| CS-SAS-AAGC | 0.9891 | 65.23 | 6.22×1011 |
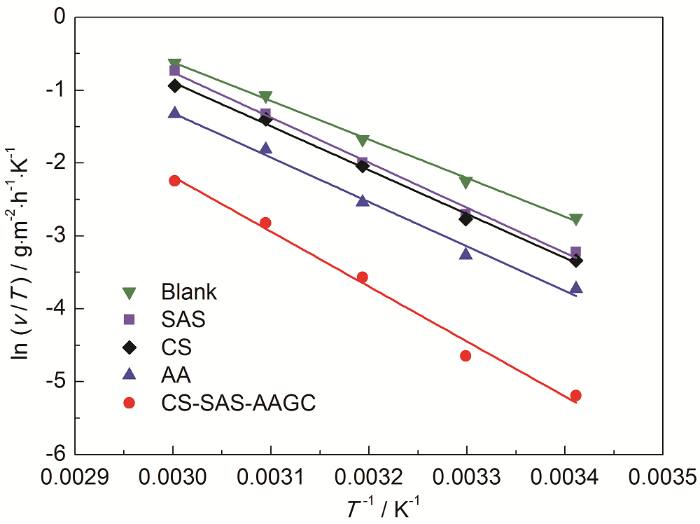
此外,根据过渡态理论有如下关系式[15]:
图6
图6
1.0 mol/L H2SO4溶液中ln(v/T)-1/T拟合直线
Fig.6
Fitted lines of ln(v/T)-1/T in1.0 mol/L H2SO4 solution
表3 ln(v/T)-1/T直线的腐蚀动力学参数
Table 3
| Inhibitor | r 2 | ∆H≠ / kJ·mol-1 | ∆S≠ / g·m-2·h-1 |
|---|---|---|---|
| Blank | 0.9967 | 44.06 | -70.51 |
| SAS | 0.9937 | 51.45 | -49.47 |
| CS | 0.9957 | 50.07 | -54.79 |
| AA | 0.9881 | 50.69 | -56.37 |
| CS-SAS-AAGC | 0.9853 | 62.63 | -27.86 |
2.5 酸浓度对CS-SAS-AAGC的缓蚀性能影响
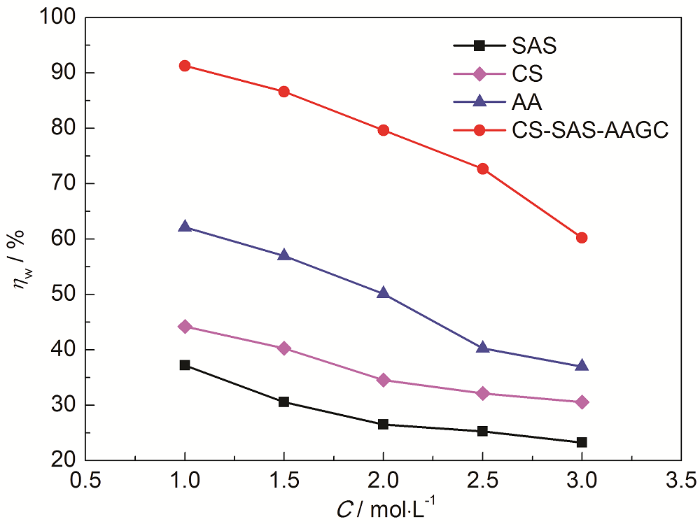
固定缓蚀剂浓度为50 mg/L、浸泡时间为6 h、温度为20 ℃,测试了缓蚀剂在1.0~3.0 mol/L H2SO4溶液中的ηw,结果如图7所示。由图可看出,随着酸浓度的增加ηw明显降低,这可能是由于钢表面在硫酸浓度增加后腐蚀程度进一步加剧,缓蚀剂分子难以形成有效缓蚀保护膜层。当酸浓度增加至3.0 mol/L时,SAS、CS、AA、CS-SAS-AAGC的缓蚀率分别下降至23.2%、30.6%、37.0%和60.2%。
图7
图7
20 ℃时缓蚀率与H2SO4溶液浓度的关系
Fig.7
Relations between inhibition efficiency and concen-tration of H2SO4 solution
钢在H2SO4溶液中的v随酸浓度的变化符合Mathur和Vasudevan经验公式[16]:
式中,C为酸浓度 (mol/L),k为速率常数 (g·m-2·h-1),B为动力学常数 (g·m-2·h-1·L·mol-1)。根据式 (9),作lnv-C拟合直线,见图8。添加缓蚀剂前后的H2SO4溶液中的腐蚀动力学参数见表4。k的数值大小代表了酸对钢的腐蚀程度的强弱,B则代表着腐蚀强度随酸浓度增加而增大的变化程度[16]。与未添加缓蚀剂的空白H2SO4溶液相比,加入缓蚀剂后k值明显减小,这表明缓蚀体系中的冷轧钢腐蚀受到了抑制,且CS-SAS-AAGC的k值明显低于CS、SAS及AA,表明接枝共聚改性后的产物CS-SAS-AAGC缓蚀效果更为优良。另一动力学参数B则在添加缓蚀剂后增大,表明冷轧钢在缓蚀体系中的腐蚀速率随酸浓度的增加而降低的幅度更为显著,尤其是对于添加接枝共聚产物CS-SAS-AAGC后的变化幅度最大。
图8
图8
20 ℃ 时H2SO4溶液中lnv-C拟合直线
Fig.8
Fitted lines of lnv-C in H2SO4 solutions at 20 ℃
表 4 lnv-C直线的腐蚀动力学参数
Table 4
| Inhibitor | r 2 | k / g·m-2·h-1 | B / g·m-2·h-1·L·mol-1 |
|---|---|---|---|
| Blank | 0.9999 | 11.25 | 0.51 |
| SAS | 0.9960 | 6.63 | 0.60 |
| CS | 0.9973 | 5.69 | 0.62 |
| AA | 0.9965 | 3.27 | 0.78 |
| CS-SAS-AAGC | 0.9981 | 0.48 | 1.26 |
2.6 腐蚀浸泡时间对CS-SAS-AAGC的缓蚀性能影响
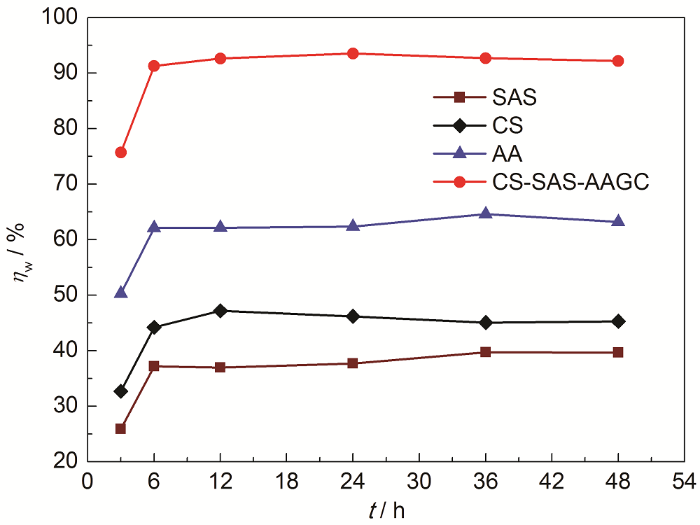
固定缓蚀剂浓度为50 mg/L、H2SO4溶液浓度为1.0 mol/L、温度为20 ℃,测试了缓蚀剂在不同浸泡时间 (3~48 h) 的ηw,结果见图9。
图9
图9
20 ℃ 时1.0 mol/L H2SO4溶液中ηw-t变化曲线
Fig.9
Changed curves of ηw-t in 1.0 mol/L H2SO4 soluti-ons at 20 ℃
从图9中可以明显看出,在3~6 h初期浸泡时间内ηw随腐蚀浸泡时间的延长而增大,随后在6~ 48 h范围内缓蚀率随腐蚀浸泡时间的延长而基本保持稳定不变。这种实验现象可解释为缓蚀剂分子形成的缓蚀吸附膜层会先随时间的延长而不断变得致密,从而缓蚀性能不断增强;当腐蚀浸泡时间逐渐延长至6 h后,缓蚀剂分子已在金属表面逐步达到了饱和,故缓蚀性能在6~48 h范围内基本保持稳定,表现出良好的缓蚀后效性。此外,在整个腐蚀浸泡时间范围内,缓蚀率排序为:CS-SAS-AAGC>AA>CS>SAS。
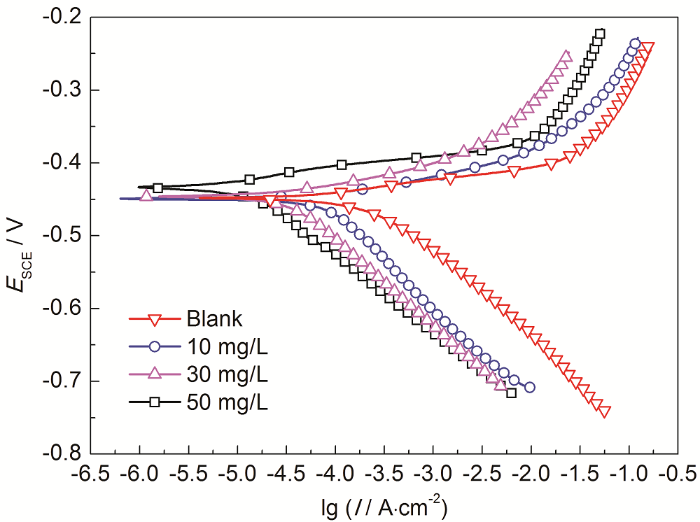
2.7 CS-SAS-AAGC在H2SO4溶液中的极化曲线特征
图10
图10
CRS在20 ℃时含CS-SAS-AAGC的1.0 mol/L H2SO4溶液中的极化曲线
Fig.10
Polarization curves for CRS in 1.0 mol/L H2SO4 solution containing CS-SAS-AAGC at 20 ℃
对图10的极化曲线进行数据拟合,结果列于表5。可以看出,加入CS-SAS-AAGC后腐蚀电流密度 (Icorr) 和空白H2SO4溶液相比下降了一个数量级,且随添加量的增加而不断下降,当浓度为50 mg/L时Icorr下降至12 μA/cm2。腐蚀电位 (Ecorr) 在添加CS-SAS-AAGC前后基本保持不变,表明CS-SAS-AAGC为同时抑制阴极和阳极的混合抑制型缓蚀剂,且作用机理为“几何覆盖效应”[18]。添加CS-SAS-AAGC后,阴极Tafel斜率 (bc) 和阳极Tafel斜率 (ba) 均有一定程度的改变,这可能是由于缓蚀剂分子在电极表面吸附后致使电极表面状态发生改变所致[18]。ηp亦随缓蚀剂浓度的增加而增大,当浓度为50 mg/L时,ηp高达95.5%,进一步印证了CS-SAS-AAGC对冷轧钢在H2SO4溶液中具有良好的缓蚀性能。
表5 20 ℃时冷轧钢在1.0 mol/L H2SO4溶液中的动电位极化参数
Table 5
| cmg·L-1 | EcorrmV (vs SCE) | IcorrμA·cm-2 | -bcmV·dec-1 | bamV·dec-1 | ηp% |
|---|---|---|---|---|---|
| --- | -448 | 268 | 124 | 17 | --- |
| 10 | -448 | 94 | 132 | 28 | 64.9 |
| 30 | -444 | 34 | 119 | 27 | 87.3 |
| 50 | -432 | 12 | 103 | 16 | 95.5 |
2.8 电化学阻抗谱 (EIS)
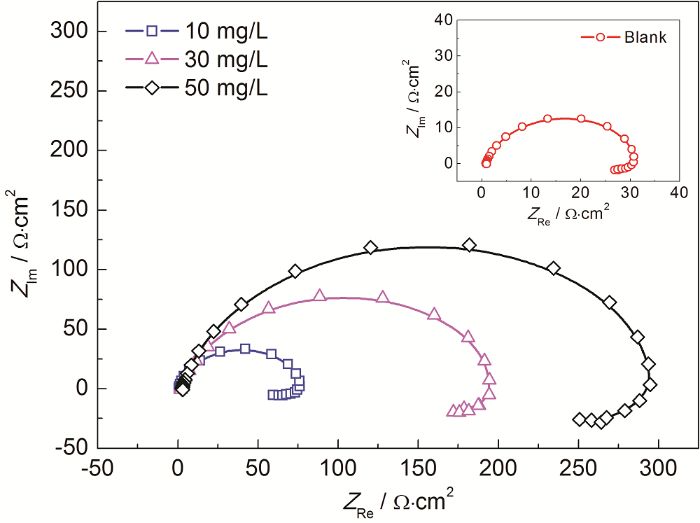
图11为20 ℃冷轧钢在1.0 mol/L H2SO4溶液中不含和含CS-SAS-AAGC的Nyquist图谱。由图11可见,该阻抗谱在高频区呈容抗弧,而在低频区出现一小段感抗弧,且在缓蚀剂CS-SAS-AAGC添加前后阻抗谱形状保持不变,表明缓蚀剂的添加未对钢的电化学腐蚀机理产生影响。高频区的容抗弧随着缓蚀剂的添加,容抗弧显著增大,故缓蚀体系中的电极阻抗值显著增大,腐蚀速率下降。值得注意的是,高频区的容抗弧不是一个完整的半圆,表明电极反应过程中存在由电极表面粗糙不均匀引起的频率弥散效应[19]。低频区的小段感抗弧可能与SO42-或缓蚀剂分子在电极表面的吸脱附所引起的电极表面不稳定状态有关[20],也可能由于阴极析氢在电极表面的弛豫过程所致。
图11
图11
钢在20 ℃时含CS-SAS-AAGC的1.0 mol/L H2SO4溶液中的Nyquist图
Fig.11
Nyquist plots for steel in 1.0 mol/L H2SO4 soluti-on containing CS-SAS-AAGC at 20 ℃
采用图12中的等效电路图对EIS拟合,图中Rs,Rt和RL分别为溶液电阻、电荷转移电阻和电感电阻,Q为常相位角元件,L为电感值。表6为EIS拟合参数。Rs数值较小,这是由于H2SO4为强电解质,故溶液的电导率较高,溶液欧姆降效应很小。和空白溶液相比,加入CS-SAS-AAGC后Rt显著增大,且随缓蚀剂浓度的增加而增大,表明CS-SAS-AAGC对冷轧钢在H2SO4中的腐蚀产生了明显的抑制作用。弥散效应系数 (a) 小于1,故电极表面确实存在频率弥散效应,且在缓蚀剂添加前后基本未发生明显改变,故弥散效应程度亦基本保持不变。L和RL均在CS-SAS-AAGC添加后明显增大,且随缓蚀剂浓度的增加而急剧上升,这可能是由于电极表面吸附的缓蚀剂分子随缓蚀剂浓度的增加而增多,进而引起的感抗效应增强。Q随CS-SAS-AAGC浓度的增加而减小,可解释为缓蚀剂分子在钢表面上发生了吸附,挤走了介电常数较大的水分子[21]。ηR随缓蚀剂浓度的增加而增大,50 mg/L时缓蚀率高达89.6%,表明CS-SAS-AAGC具有良好的缓蚀性能。
图12
表6 20 ℃时冷轧钢在1.0 mol/L H2SO4中的电化学阻抗谱参数
Table 6
| cmg·L-1 | RsΩ·cm2 | RtΩ·cm2 | RLΩ·cm2 | QΩ·cm2 | aμΩ·sa·cm-2 | LH·cm2 | ηR% |
|---|---|---|---|---|---|---|---|
| --- | 0.83 | 31 | 177 | 540 | 0.8591 | 129 | --- |
| 10 | 0.67 | 76 | 296 | 314 | 0.9195 | 1051 | 59.2 |
| 30 | 1.76 | 202 | 1069 | 205 | 0.8513 | 1963 | 84.7 |
| 50 | 2.66 | 298 | 1232 | 139 | 0.8733 | 5378 | 89.6 |
2.9 冷轧钢表面的SEM微观形貌
图13
图13
冷轧钢表面浸泡前后的SEM微观形貌
Fig.13
SEM micrographs of cold rolled steel surfaces: (a) before immersion, (b) corrosion immersion in 1.0 mol/L H2SO4 at 20 ℃ for 6 h, (c) corrosion immersion in 1.0 mol/L H2SO4 containing 50 mg/L CS-SAS-AAGC at 20 ℃ for 6 h
2.10 冷轧钢表面的接触角测试
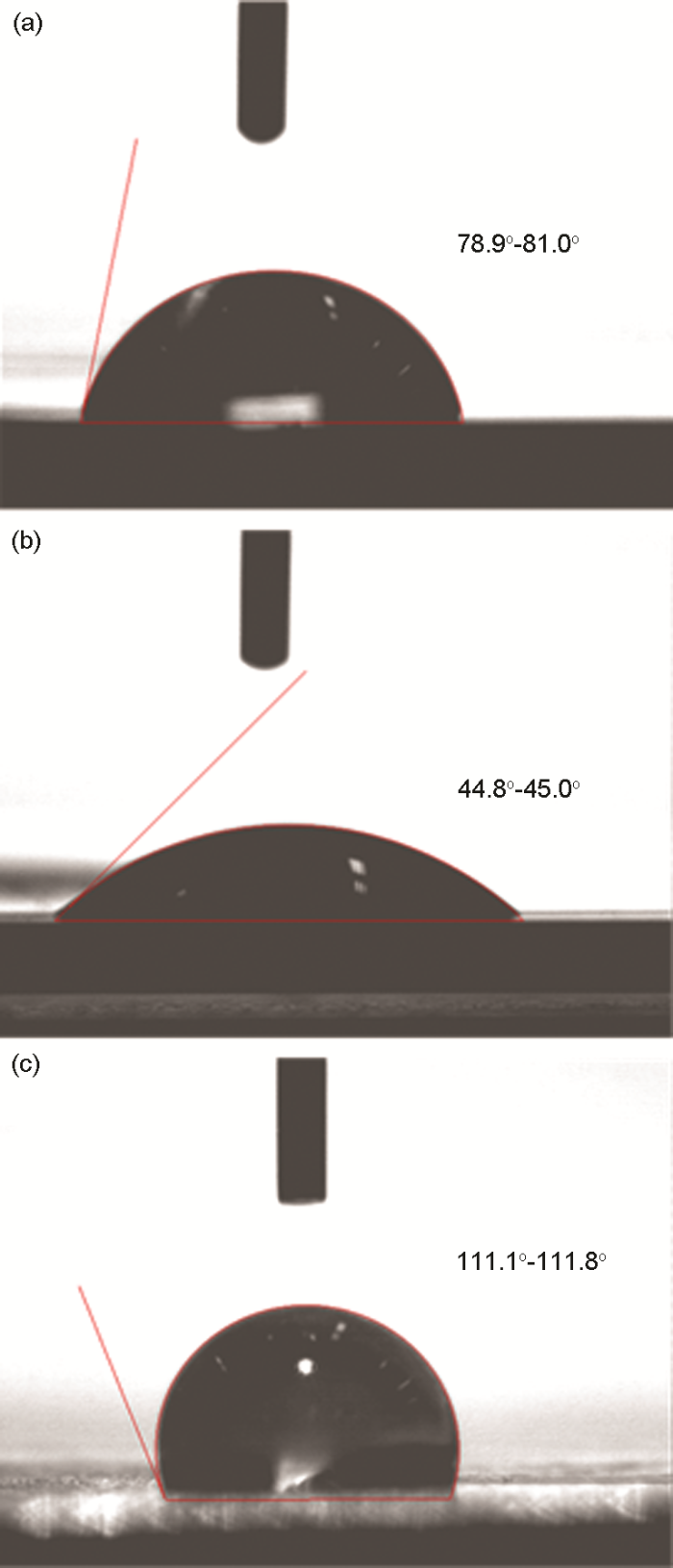
图14为水滴在冷轧钢表面的接触角图片及角度值。从图14a中可以看出,表面处理后的钢表面的接触角78.9o~81.0o,表明钢表面具有亲水性质,故水溶液可在表面润湿;图14b为冷轧钢表面在1.0 mol/L H2SO4溶液中腐蚀浸泡6 h后接触角下降至44.8o~45.0o,表明钢表面的亲水性进一步增强,这可能与钢的腐蚀表面粗糙不平有关,因而水滴更易在其表面润湿。由图14c可以看出,钢表面在含有50 mg/L CS-SAS-AAGC的1.0 mol/L H2SO4溶液中浸泡6 h后的接触角增大至111.1o~111.8o,即在缓蚀体系中钢表面具有较强的疏水性,可有效屏蔽酸溶液对钢表面的腐蚀,从而表现出良好的缓蚀性能。
图14
图14
冷轧钢表面浸泡前后的接触角形貌
Fig.14
Contact angle images of cold rolled steel surfaces: (a) before immersion, (b) corrosion immersion in 1.0 mol/L H2SO4 at 20 ℃ for 6 h, (c) corrosion immersion in 1.0 mol/L H2SO4 containing 50 mg/L CS-SAS-AAGC at 20 ℃ for 6 h
2.11 缓蚀作用机理
图15
图15
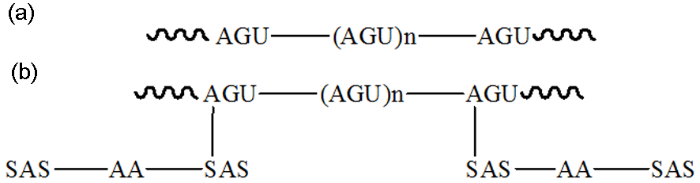
CS和CS-SAS-AAGC的分子结构式
Fig.15
Molecular structures of CS (a) and CS-SAS-AAGC (b)
质子化的CSHxx+和带正电的钢表面之间存在静电斥力,很难依靠分子间的作用力吸附在钢表面,故木薯淀粉单独使用时缓蚀效果较差。
当SAS和AA接枝在CS上形成三元接枝共聚物结构示意图见图15b,可以看出,SAS在水溶液中电离出Na+后带负电,故整个接枝共聚物CS-SAS-AAGC是带负电荷的,从而使之与带正电荷的钢表面之间存在静电引力作用,从而更易在钢表面发生吸附。当两者之间产生静电引力吸附后,CS-SAS-AAGC中的O、N、S原子具有大量的孤对电子,是良好的螯合配位体;故它可以与铁的空d轨道形成配位键发生化学吸附,在钢表面形成吸附膜层。
3 结论
木薯淀粉三元接枝共聚物CS-SAS-AAGC对冷轧钢在1.0 mol/L H2SO4溶液中具有良好的缓蚀作用,20 ℃时缓蚀剂用量仅为50 mg/L时缓蚀率超过90%。CS-SAS-AAGC在钢表面的吸附符合Langmuir吸附模型,吸附作用方式为物理吸附为主的混合吸附;CS-SAS-AAGC为抑制阴极为主的混合抑制型缓蚀剂,作用机理方式为“几何覆盖效应”;Nyquist图谱在高频区呈弥散容抗弧,而在低频区出现小段感抗弧,电荷转移电阻随缓蚀剂浓度的增加而增大,但常相位角元件下降。添加CS-SAS-AAGC后的钢表面腐蚀程度下降,且具有疏水性。
参考文献
Reviews on corrosion inhibitors: A short view
[J].
Application of carbohydrate polymers as corrosion inhibitors for metal substrates in different media: A review
[J].
Corrosion inhibition of mild steel in HCl solution by pectin
[J].
Eco friendly green inhibitor Gum Arabic (GA) for the corrosion control of mild steel in hydrochloric acid medium
[J].
Inhibition of mild steel corrosion in HCl solution using chitosan
[J].
Adsorption behavior and inhibition corrosion effect of sodium carboxymethyl cellulose on mild steel in acidic medium
[J].
Experimental and theoretical studies of xanthan gum and its graft co-polymer as corrosion inhibitor for mild steel in 15% HCl
[J].
Corrosion inhibition of mild steel in acidic medium by polyacrylamide grafted Guar gum with various grafting percentage: Effect of intramolecular synergism
[J].
Corrosion inhibition of cassava starch graft acryl amide copolymer for cold rolled steel in hydrochloric acid
[J].
木薯淀粉接枝共聚物在盐酸介质中对冷轧钢的缓蚀作用
[J].
Cassava starch graft copolymer as an eco-friendly corrosion inhibitor for steel in H2SO4 solution
[J].
Characterization of irradiated starches by using FT-Raman and FTIR spectroscopy
[J].
The adsorption and corrosion inhibition of anion surfactants on aluminium surface in hydrochloric acid
[J].
A effect of sodium dodecylsulfate on the corrosion of copper in sulphuric acid media
[J].
A combined electrochemical and theoretical study into the effect of 2-((thiazole-2-ylimino) methyl) phenol as a corrosion inhibitor for mild steel in a highly acidic environment
[J].
New organic compounds based on siloxane moiety as corrosion inhibitors for carbon steel in HCl solution: Weight loss, electrochemical and surface studies
[J].
Reaction rate studies for the corrosion of metals in acids—I, iron in mineral acids
[J].
Gravimetric, electrochemical and quantum chemical studies of some pyridazine derivatives as corrosion inhibitors for mild steel in 1M HCl solution
[J].
One electrochemical techniques for interface inhibitor research
[J].
Electrochemical impedance spectroscopy and electrochemical noise measurements as tools to evaluate corrosion inhibition of azole compounds on stainless steel in acidic media
[J].
Study of the mechanism and inhibiting efficiency of 3,5-bis (4-methylthiophenyl) -4H-1,2,4-triazole on mild steel corrosion in acidic media
[J].
Determination of corrosion rates by electrochemical DC and AC methods
[J].
The inhibition of the corrosion of pure iron in 0.5 M sulphuric acid by n-alkyl quaternary ammonium iodides
[J].
Critique of inhibitor evaluation by polarization measurement
[J].